Бифидумбактерин Форте инструкция по применению: показания, противопоказания, побочное действие – описание Bifidumbacterin Forte капс. 50 млн.КОЕ (5 доз): банки 10, 18 или 30 шт. (18724)
Препарат принимают внутрь во время приема пищи, при необходимости — независимо от приема пищи.
Препарат в форме капсул назначают взрослым и детям в возрасте 3 лет и старше. Капсулы принимают, запивая кипяченой водой или кисломолочным продуктом. Для детей при необходимости капсулы вскрывают, и смешивают ее содержимое с жидкой пищей, предпочтительно с кисломолочным продуктом. Содержимое капсулы можно смешать с 20-50 мл кипяченой воды комнатной температуры, при этом образуется мутная взвесь с частичками сорбента черного цвета. Полученную водную взвесь следует выпить, не добиваясь полного растворения.
Препарат в форме порошка для приема внутрь назначают взрослым и детям всех возрастных групп. Порошок перед употреблением смешивают с жидкой пищей, предпочтительно с кисломолочным продуктом, для новорожденных и грудных детей — с материнским молоком или смесью для искусственного вскармливания.
В зависимости от тяжести заболеваний Бифидумбактерин форте применяют в обычных или увеличенных дозах.
С целью лечения препарат в обычных дозах назначают пациентам всех возрастных групп.
Обычная доза для взрослых составляет по 2 капсулы или по 2 пакетика 2-3 раза/сут; для детей в возрасте 3 лет и старше — по 1 капсуле 3-4 раза/сут, в возрасте 1 года и старше — по 1 пакетику 3-4 раза/сут, в возрасте до 1 года — по 1 пакетику 2-3 раза/сут.
Курс лечения при острых кишечных инфекциях и пищевых токсикоинфекциях составляет 5-7 дней, при других заболеваниях — 15-21 день, в зависимости от характера и тяжести заболевания. При необходимости курсы лечения можно повторить 2-3 раза, каждый курс проводится через месяц после окончания предыдущего курса лечения.
При хирургической патологии препарат применяют в течение 3-5 дней до операции и в течение 10-15 дней после операции: взрослым назначают по 2 капсулы или по 2 пакетика 3 раза/сут; детям в возрасте 3 лет и старше — по 1 капсуле 3-4 раза/сут, в возрасте 1 года и старше — по 1 пакетику 3-4 раза/сут, в возрасте до 1 года — по 1 пакетику 3 раза/сут.
С целью лечения препарат в увеличенных дозах назначают взрослым и детям в возрасте 1 года и старше.
При острой кишечной инфекции и острой респираторной вирусной инфекции препарат назначают с первых суток заболевания: взрослым — по 10 капсул или по 10 пакетиков 3 раза/сут; детям в возрасте 3 лет и старше — по 3-5 капсул каждые 2 ч до 6 раз/сут,
При хронических заболеваниях ЖКТ назначают взрослым по 10 капсул или 10 пакетиков 1-3 раза/сут; детям в возрасте 3 лет и старше — по 5 капсул 1-3 раза/сут, в возрасте 1 года и старше — по 5 пакетиков 1-3 раза/сут. Курс лечения составляет 10-14 дней.
Курс лечения составляет 10-14 дней.
При применении у детей капсулы рекомендуется вскрывать и смешивать их содержимое с 50 мл кипяченой воды комнатной температуры.
С целью профилактики Бифидумбактерин форте назначают взрослым и детям старше 3 лет по 1-2 капсулы или по 1-2 пакетика 1-2 раза/сут; детям в возрасте до 1 года — по 1 пакетику 1 раз/сут. Профилактический курс составляет 10-15 дней 2-3 раза/год. Для профилактики внутрибольничных инфекций в родильных домах и больницах препарат применяют 5-10 дней.
противопоказания, побочное действие, дозировки, состав – в справочнике лекарственных средств
Бифидумбактерин сухой при кишечных заболеваниях применяют перорально, а в акушерско-гинекологической практике интравагинально.
С флакона удаляют металлический колпачок и резиновую пробку. Содержимое флакона растворяют кипяченой водой комнатной температуры из расчета 1 чайная ложка на 1 дозу лекарственного средства.
Способ растворения:
- в стакан наливают требуемое количество чайных ложек воды (в соответствии с числом доз, указанных на этикетке тары), затем из стакана переносят во флакон небольшое количество воды для растворения сухой массы.
 После растворения содержимое флакона переносят в тот же стакан и перемешивают.
После растворения содержимое флакона переносят в тот же стакан и перемешивают.
Одна чайная ложка растворенного таким образом лекарственного средства составляет одну дозу. Необходимое количество доз (соответственно чайных ложек) выпивают за 20-30 мин до еды. Грудным детям лекарственное средство можно давать непосредственно перед кормлением.
При кишечных заболеваниях длительность курса лечения бифидумбактерином определяется тяжестью клинических проявлений, возрастом больного и составляет 2-4 недели, а в отдельных случаях до 3-х месяцев. С профилактической целью назначают по 5 доз 1-2 раза/сут в течение 1-2 недель.
Новорожденным группы «риска» целесообразно начинать применение лекарственного средства в родильном отделении с первых суток жизни до выписки по 1-2 дозы на прием 3 раза/сут.
При кишечных заболеваниях детям первого полугодия жизни лекарственное средство назначают по 3 дозы на прием 3 раза/сут. Детям второго полугодия и старше — по 5 доз 2 раза/сут.
При возникновении у детей нарушений функций ЖКТ и угрозы язвенно-некротического энтероколита назначают до 10 доз в сут.
При острых хронических воспалительных заболеваниях тонкого и толстого кишечника, колитах и энтероколитах у взрослых рекомендуется по 5 доз 2-3 раза/сут.
В комплексной терапии с антибиотиками и другими антибактериальными препаратами рекомендуется:
- детям до 1 года по 5 доз 2-3 раза/сут, детям старше 1 года по 5 доз 3-4 раза/сут, взрослым по 10 доз 2-3 раза/сут.
Для интравагинального введения бифидумбактерин растворяют выше указанным способом. Полученной взвесью лекарственного средства пропитывают стерильный тампон, который вводят интравагинально и оставляют на 2-3 ч.
При воспалительных гинекологических заболеваниях и предродовой подготовке беременных группы «риска» бифидумбактерин назначают по 5-10 доз 1 раз/сут в течение 5-8 дней под контролем восстановления чистоты вагинального секрета до I-II степени и исчезновения клинических симптомов воспаления.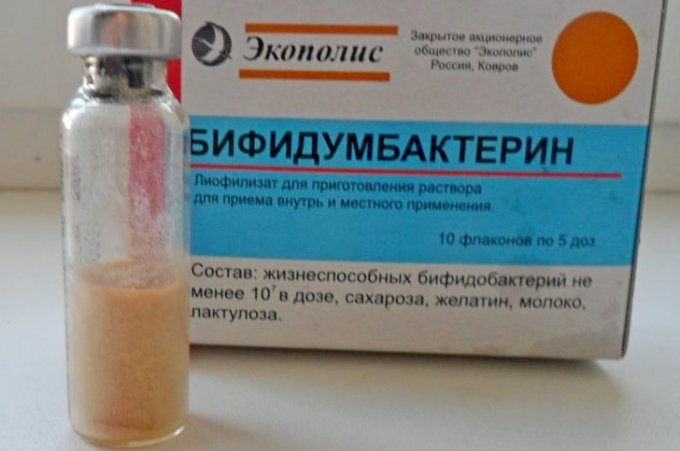
Инструкция Бифидумбактерин Форте® — компания Аван
Скачать инструкцию (порошки) Скачать инструкцию (капсулы)
Регистрационный номер
| Порошок | Капсулы |
| Р N000361/01 | ЛСР-007830/08 |
Торговое наименование
БИФИДУМБАКТЕРИН ФОРТЕ®
Группировочное наименование
Бифидобактерии бифидум
Лекарственная форма
| Порошок | Капсулы |
| Порошок для приема внутрь | Капсулы |
Состав
| Порошок | Капсулы |
Один пакет содержит:
| Одна капсула содержит:
|
Описание
| Порошок | Капсулы |
| Порошок от светло-серого до темно-серого цвета с черными частицами угля и возможными вкраплениями бежевого цвета со слабым кисломолочным запахом. | Твердые желатиновые капсулы, корпус капсулы белого цвета, крышечка капсулы голубого цвета. Содержимое капсул — порошок от светлосерого до темно-серого цвета с черными частицами угля и возможными вкраплениями бежевого цвета со слабым кисломолочным запахом. |
Фармакотерапевтическая группа
Медицинский иммунобиологический препарат — пробиотик
Код АТХ
A07FA
Биологические свойства
Действие препарата обусловлено высокой концентрацией сорбированных на частицах активированного угля бифидобактерий (Bifidobacterium bifidum), являющихся антагонистами широкого спектра патогенных (шигеллы, сальмонеллы, золотистый стафилококк и др.) и условно патогенных микроорганизмов (протей, клебсиелла и др.
Показания для применения
- Дисбактериозы кишечника различной этиологии (в т.ч. вызванные приемом антибиотиков, антибактериальных препаратов, глюкокортикостероидных гормонов, препаратов, оказывающих ульцерогенное действие на желудочнокишечный тракт),
- острые кишечные инфекции установленной (шигеллез, сальмонеллез, стафилококковый энтероколит, ротавирусная инфекция) и неустановленной этиологии,
- пищевые токсикоинфекции.
В составе комплексной терапии заболеваний, сопровождающихся дисбактериозом кишечника:
- хронические заболевания с поражением желудочно-кишечного тракта (язвенная болезнь желудка и двенадцатиперстной кишки, панкреатит, холецистит, заболевания печени и желчевыводящих путей, хронические запоры,синдром мальабсорбции),
- аллергические заболевания,
- пневмонии, острые и хронические бронхиты,
- острые респираторные вирусные инфекции,
- инфекционный мононуклеоз,
- воспалительные заболевания урогенитального тракта,
- у больных хирургического профиля в период предоперационной подготовки и после операций на кишечнике, печени, поджелудочной железе для коррекции микробиоценоза кишечника и профилактики гнойно-воспалительных заболеваний.

Препарат применяют для профилактики:
- внутригоспитальных инфекций в родильных домах и больницах,
- дисбактериозов у часто болеющих ОРВИ детей и взрослых.
| Капсулы |
| диарея у больных длительно леченных антибиотиками |
Противопоказания для применения
Врожденная недостаточность лактазы. Нарушение всасывания глюкозыгалактозы.
Режим дозирования, курс лечения и способ введения
Препарат применяют детям с рождения (в том числе недоношенным), взрослым всех возрастных групп.
В зависимости от тяжести заболеваний Бифидумбактерин форте® применяют в обычных или увеличенных дозах.
Бифидумбактерин форте® с лечебными целями в обычных дозах:
| Порошок | Капсулы |
| — детям до 1 года по 1 пакету 2-3 раза в сутки, — детям с 1 года и старше по 1 пакету 3-4 раза в сутки, — взрослым по 2 пакета 2-3 раза в сутки.  | — детям до года по 1 капсуле 2-3 раза в сутки, — детям с 1 года и старше по 1 капсуле 3-4 раза в сутки, — взрослым по 2 капсулы 2-3 раза в сутки. |
Курс лечения при острых кишечных инфекциях и пищевых токсикоинфекциях 5-7 дней, при других заболеваниях 15-21 день (определяется характером и тяжестью заболевания). При необходимости курс лечения можно повторить 2-3 раза, каждый курс проводится через месяц после окончания предыдущего курса лечения.
Больным с хирургической патологией — в течение 3-5 дней до операции и в
течение 10-15 дней после операции:
- детям до 1 года по 1 пакету/капсуле 3 раза в сутки,
- детям с 1 года и старше по 1 пакету/капсуле 3-4 раза в сутки,
- взрослым по 2 пакета/капсуле 3 раза в сутки.
Бифидумбактерин форте® с лечебными целями в увеличенных дозах
назначают детям с 1 года и взрослым.
При острой кишечной инфекции и острой респираторной вирусной инфекции с первых суток заболевания:
| Порошок | Капсулы |
| — детям по 5 пакетов 6 раз в день, — взрослым по 10 пакетов 3 раза в день | — детям по 3-5 капсул каждые 2 часа до 6 раз в день, — взрослым по 10 капсул 3 раза в день.  |
Курс лечения 1-3 дня в зависимости от тяжести состояния.
| Порошок |
| При инфекционном мононуклеозе: — детям до 3 лет по 3 пакета 3 раза в сутки, курс 5 дней; затем 3 пакета однократно вечером, курс 5 дней, — детям с 3 до 7 лет по 4 пакета 3 раза в сутки, курс 5 дней; затем 4 пакета однократно вечером, курс 5 дней, — детям с 7 до 10 лет по 6 пакетов 3 раза в сутки, курс 5дней; затем 6 пакетов однократно вечером, курс 5 дней, — детям старше 10 лет по 7-8 пакетов 3 раза в сутки, курс 5 дней; затем 7-8 пакетов однократно вечером, курс 5 дней. |
При хронических заболеваниях желудочно-кишечного тракта:
- детям по 5 пакетов/капсул 1-3 раза в сутки,
- взрослым по 10 пакетов/капсул 1-3 раза в сутки.
Курс лечения 10-14 дней.
Пациентам с сахарным диабетом необходимо учитывать, что
| Порошок | Капсулы |
в 5 пакетах препарата содержится 0,35 ХЕ. | в 10 капсулах препарата содержится 1,17 ХЕ. |
С профилактическими целями детям до 1 года по 1 пакету/капсуле 1 раз в сутки, всем остальным по 1-2 пакета/капсуле 1-2 раза в сутки.
| Порошок | Капсулы |
| Профилактический курс проводят 10-15 дней 2-3 раза в год. | Для профилактики внутригоспитальных инфекций в родильных домах и больницах препарат применяют 5-l0 дней. |
| Порошок | Капсулы |
| Бифидумбактерин форте® принимают во время приема пищи, при необходимости независимо от приема пищи. Препарат перед употреблением смешивают с жидкой пищей, желательно кисломолочным продуктом, или небольшим количеством кипяченой воды комнатной температуры для получения взвеси с частичками сорбента черного цвета. Полученную взвесь (суспензию) следует выпить, не добиваясь полного растворения. | Бифидумбактерин форте® принимают внутрь во время приема пищи, при необходимости независимо от приема пищи, запивая водой или кисломолочным продуктом.  Детям и пациентам, которые не могут проглотить целую капсулу, ее вскрывают. Содержимое капсулы смешивают с жидкой пищей, желательно кисломолочным продуктом или небольшим количеством кипяченой воды комнатной температуры для получения взвеси с частичками сорбента черного цвета. Полученную взвесь (суспензию) следует выпить, не добиваясь полного растворения. |
Новорожденным и детям грудного возраста препарат можно смешать с материнским молоком или смесью для искусственного вскармливания.
Меры предосторожности при применении
Применение препарата не требует соблюдения специальных мер
предосторожности.
Симптомы передозировки
Случаев передозировки не наблюдалось.
Возможные побочные действия
Не установлены.
Взаимодействие с другими лекарственными средствами
При одновременном приеме Бифидумбактерин форте® форте с витаминами (особенно группы В) действие препарата усиливается. При приеме антибиотиков рекомендованный интервал между приемом антибиотика и препарата Бифидумбактерин форте® форте составляет 3 – 4 часа.
При приеме антибиотиков рекомендованный интервал между приемом антибиотика и препарата Бифидумбактерин форте® форте составляет 3 – 4 часа.
Возможность применения препарата в периоды беременности и грудного вскармливания
Препарат разрешен для применения женщинам в периоды беременности и грудного вскармливания. Особых условий приема нет.
Влияние препарата на способности управлять транспортными средствами, механизмами
Препарат не влияет на способность управлять транспортными средствами, механизмами.
Форма выпуска
| Порошок | Капсулы |
| Бифидумбактерин форте® порошок для приема внутрь, 50 млн КОЕ сорбированных бифидобактерий в пакете из многослойного металлополимерного материала. По 10 или 30 пакетов с инструкцией по применению в пачке из картона. В одном пакете 5 доз. | 10, 18, 30 капсул по 5 доз упакованы в банки из полимерного материала. Банка помещается вместе с инструкцией по применению в пачку из картона. |
Срок годности
| Порошок | Капсулы |
| 2 года. | 1 год. |
Препарат не пригоден для применения по истечении срока годности, при изменении внешнего вида, при отсутствии или нечеткой маркировке на первичной упаковке, при нарушении герметичности первичной упаковки.
Условия хранения
ХРАНИТЬ В НЕДОСТУПНОМ ДЛЯ ДЕТЕЙ МЕСТЕ.
| Порошок | Капсулы |
| Хранить при температуре не выше 10°С. Нижняя граница температуры не лимитируется. | Хранить при температуре от 2 до 10°С. |
Условия транспортирования
| Порошок | Капсулы |
| Транспортирование при температуре не выше 10°C. Допускается транспортирование препарата при температуре не выше 25°C не более 10 суток. Нижняя граница температуры не лимитируется. | Транспортирование при температуре от 2 до 10°С.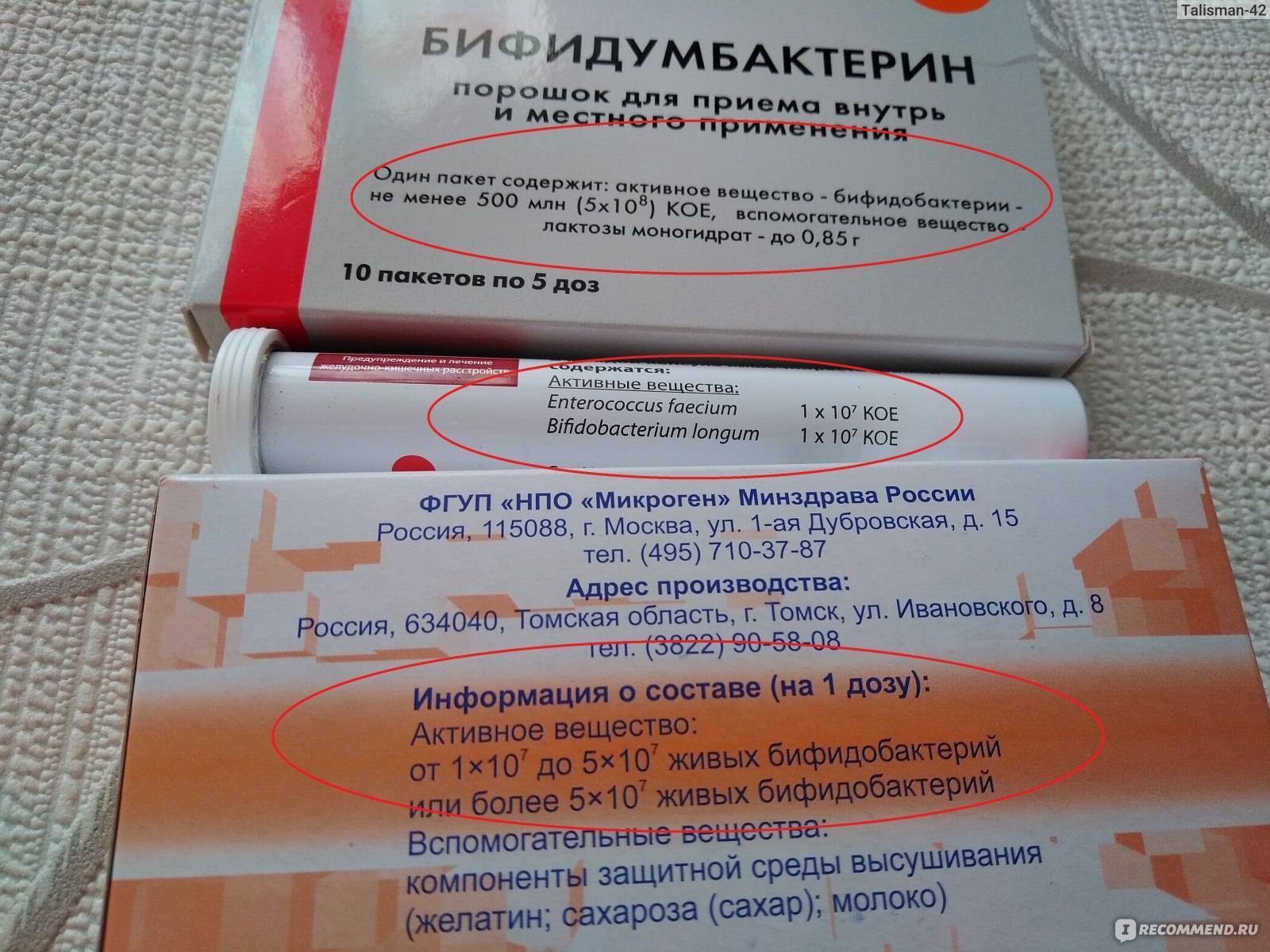 Допускается транспортирование препарата при температуре не выше 20°С не более 10 суток. Допускается транспортирование препарата при температуре не выше 20°С не более 10 суток. |
Условия отпуска
Отпускается без рецепта.
Владелец регистрационного удостоверения
Общество с ограниченной ответственностью «АВАН», Россия
Наименование, адрес предприятия-производителя лекарственного препарата
Акционерное общество «Партнер», 19180, Москва, ул. Большая Якиманка, дом 31.
Адрес места производства лекарственного препарата
143981, Московская область, г. Балашиха, мкр. Кучино, ул. Южная, д. 11.
Рекламации на качество или побочное действие препарата следует направлять предприятию-производителю по адресу: Акционерное общество «Партнер» 19180, Москва, ул. Большая Якиманка, дом 31.
Тел.: (495) 925-51-09, факс (495) 765-52-40.
БИОЛОГИЧЕСКИЕ ИММУНОМОДУЛЯТОРЫ В КОМПЛЕКСНОЙ ТЕРАПИИ ИНФЕКЦИОННОГО МОНОНУКЛЕОЗА У ДЕТЕЙ | Боковой
1. Гранитов В.М. Герпесвирусная инфекция. — Н. Новгород: НГМА. — 2001—80 с.
Гранитов В.М. Герпесвирусная инфекция. — Н. Новгород: НГМА. — 2001—80 с.
2. Горячева Л.Г. Применение циклоферона в педиатрии / Л.Г. Горячева, В.В. Ботвиньева, М.Г. Романцов. — 2104. — М. — С. Петербург. — 58 с.
3. Краснов В.В. Инфекционный мононуклеоз. Клиника, диагностика, современные принципы лечения. — С. Петербург — Н. Новгород. — 2003. — 43 с.
4. Ершов Ф.И. Современный арсенал антигерпетических лекарственных средств / Ф.И. Ершов, Т.П. Оспельникова // Инфекции и антимикробная терапия. — 2001. — Т. 3. — № 4. — С. 100— 104.
5. Hickey S.M., Strasburger V.C. What every pediatrician should know infectiousmononucleosis in adolescents // Pediatr. Clin. North. Am. — 1997. — V. 44. —№ 6. — P. 1541—1556.
44. —№ 6. — P. 1541—1556.
6. Red Book. American Academy of Pediatrics / J.S. Abramson et al. — 2000. — P. 240—244.
7. Детские инфекционные болезни / В.В. Фомин и др. — Екатеринбург, 2000. — Ч. 1. — С. 661—686.
8. Учайкин В.Ф. Руководство по инфекционным болезням у детей. — М.: ГЭОТАР Медицина, 1998. — 809 с.
9. Ко-инфекция при ОРВИ-пневмониях у детей и обоснование применения высоких доз бифидумбактерина-форте для иммунобиологической коррекции / Лыкова Е.А. и др. // Тезисы V Российской конференции «Современные проблемы антимикробной химиотерапии». — М., 2—3 октября, 2000. — С. 12—16.
10. Лечение острых кишечных инфекций у детей препаратами бифидумбактерин-форте и пробифор / Новокшонов А. А. и др. — Москва, 2001. — 16 с.
А. и др. — Москва, 2001. — 16 с.
11. Использование больших доз пробиотика бифидумбактерина форте в лечении ОРВИ у детей: клинические и иммунобиологические результаты / Воробьев А.А. и др. // Эпидемиология и инфекционные болезни. — 2004. — № 5. — С. 43—46.
Технологические аспекты производства бифидумбактерина Текст научной статьи по специальности «Промышленные биотехнологии»
СИБИРСКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ № 22009 (выпуск 2)
УДК 615.453.42:579.873.13
М.И. Демешева, Л.Н. Мезенцева, Т.Д. Лимарева, Е.В. Князюк
E-mail: dem @virion.tomsknet.ru
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ ПРОИЗВОДСТВА БИФИДУМБАКТЕРИНА
Филиал ФГУП «НПО «Микроген» МЗ РФ г Томск «НПО «Вирион»
ВВЕДЕНИЕ
Проблема дисбиотических состояний является актуальной для медицины и требует практических решений, связанных с необходимостью организации различных лекарственных форм пробиотиков.
Одним из эффективных средств коррекции дисбактериозов является препарат бифидумбактерин. В настоящее время этот препарат выпускается в виде лиофильно высушенной биомассы во флаконах, что не в полной мере отвечает требованиям фармацевтического рынка.
Для повышения его потребительских свойств необходима организация производства в виде дозированных порошков и капсул, способ получения которых предполагает использование стабильной по биологическим и технологическим параметрам сухой биомассы бифидобактерий.
Исследования, направленные на разработку и усовершенствование технологии указанных лекарственных форм бифидумбактерина, являются актуальными для производства пробиотиков.
Цель настоящего исследования — разработка технологии и стандартизация пероральных дозированных лекарственных форм на основе сухой биомассы бифидобактерий.
МАТЕРИАЛ И МЕТОДЫ
В работе использовали производственный штамм Bifidobacterium bifidum №1, который принадлежит к виду Bifidobacterium bifidum, роду Bifidobacterium, семейству Actinomycetaceae.
Для получения маточной культуры бифидобактерий и контроля биологических показателей использовали среду Блаурокка. При глубинном культивировании бифидобактерий в реакторе применяли питательную среду на основе панкреатического гидролизата казеина и дрожжевого аутолизата (КД-5) и новые варианты производственных сред, изготовленных из соевой муки (ТУ № 9293-001-48386138-99) и дрожжевого аутолизата.
Процесс периодического культивирования бифидобактерий проводили в реакторе типа Биор в условиях рН-статирования при температуре (38±1)°С в атмосфере инертного газа.
Оптическую плотность растущей культуры бифидобактерий в процессах периодического культивирования измеряли при помощи фотоэлектроколориметра ФЭК 56М (зеленый светофильтр, кювета 10 мм).
Длительность фаз роста культуры определяли графически. Показатели роста культуры бифидобактерий — удельную скорость роста, удельную активность кислотообразования, время генерации, величину урожая клеток рассчитывали по формулам, рекомендованным С.М. Ждан-Пушкиной [40].
Гигроскопичность образцов биомассы для кап-сулирования (1 г в бюксе) оценивали по их влагопоглощающей способности, которую изучали гравиметрическим методом в эксикаторах с 77- и 100-процентной относительной влажностью воздуха при температуре (20±2)°С. Бюксы взвешивали с точностью до 0,0001 г для проведения расчетов влаго-поглощения образцов биомассы I3I.
Сыпучесть определяли с помощью прибора ВП-12А. Для оценки сыпучести использовали следующие градации: 3,0-6,5 г/с — удовлетворительная, 2,0-3,0 г/с — допустимая, 1,0-2,0 г/с — плохая,
0,3-1,0 г/с — очень плохая. Насыпную плотность рассчитывали как отношение массы порошка к занимаемому объему при свободном насыпании (кг/м3).
Насыпную плотность рассчитывали как отношение массы порошка к занимаемому объему при свободном насыпании (кг/м3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На основании изучения показателей роста Bifidobacterium bifidum построена полулогарифмическая кривая изменения оптической плотности, по которой были установлены основные фазы роста культуры бифидобактерий (рис. 1).
В анализируемых процессах лаг-фаза продолжалась четыре часа и характеризовалась незначительными изменениями оптической плотности. Перед наступлением экспоненциальной фазы между 3 и 4 часами наблюдалось уменьшение оптической плотности, что можно объяснить началом деления мик-
1 2 3 -1 5 А 7 4 А 10 11 12 13 И 15 16 17
ареии, чк
о число клеток по стандарту мутности
—ЧОПИЧЙСГРО к№гсн бифиде*актй0ий
Рис. 1. Изменение концентрации бифидобактерий в процессе культивирования
1. Изменение концентрации бифидобактерий в процессе культивирования
робных клеток. Фаза экспоненциального роста продолжалась 8-9 часов. Затем мы наблюдали переход культуры в стационарную фазу.
При этом происходит увеличение общего количества бифидобактерий до 10 млрд общего числа клеток в 1 мл. Концентрация жизнеспособных клеток к 12-13 ч. процесса достигала максимума и составляла 4-6 х109 КОЕ/мл, далее наблюдалось падение числа жизнеспособных клеток.
С учетом выявленных закономерностей роста культуры были проведены исследования по выбору оптимального времени прекращения процесса культивирования. С периодичностью в один час с 9-го -по 16-й час культивирования отбирали пробы, которые подвергали лиофилизации. В полученных образцах определяли количество жизнеспособных клеток до и после высушивания, а также в процессе хранения. Анализ полученных данных выявил существенные различия исследуемых образцов по степени отмирания клеток при хранении.
Анализ полученных данных выявил существенные различия исследуемых образцов по степени отмирания клеток при хранении.
Установлено, что при длительном хранении наибольшие количества (84-85%) живых клеток сохраняются в образцах, взятых на 12, 13, 14 часах культивирования.
С учетом этого была выбрана оптимальная продолжительность периодического культивирования бифидобактерий — 12-14 часов, позволяющая получать стабильную по биологическим свойствам сухую массу бифидобактерий.
Для накопления биомассы в производстве бифи-думбактерина предусмотрено использование казеиново-дрожжевой среды. Применение в составе питательной среды гидролизата казеина не является оптимальным как по длительности приготовления, так и по себестоимости данного полуфабриката.
Для модификации казеиново-дрожжевой среды была изучена возможность замены гидролизата казеина на соевый бульон, приготовленный из соевой муки.
При разработке соево-дрожжевой питательной среды апробированы различные способы ее приготовления. Введение дрожжевого субстрата в питательную среду производилось тремя способами: в виде дрожжевого аутолизата, приготовленного рег-
ламентированным способом, дрожжевой массы без аутолиза и дрожжевого осадка после аутолиза.
При испытании соево-дрожжевых сред в качестве контроля использовали среду КД №5, а также варианты сред, содержащих монооснову: соевой бульон или дрожжевой аутолизат.
В результате проведенных экспериментов установлено, что достаточно высокими ростовыми свойствами для культуры бифидобактерий обладают питательные среды, содержащие в своем составе как монооснову, так и поликомпонентный субстрат.
При сравнении питательных сред, близких по составу, но различных по технологии приготовления, выяснилось, что лучшими ростовыми свойствами обладает соево-дрожжевая среда, приготовленная на основе дрожжевого аутолизата.
Испытание соево-дрожжевой среды в производственных условиях осуществляли в реакторе типа «Биор» с объемом загрузки среды 40 л. Результаты данного этапа эксперимента показали, что соеводрожжевая среда по удельной скорости роста и времени генерации фактически не отличается от казеиново-дрожжевой среды. Значимых различий не имели показатели прироста биомассы и выживаемости бифидобактерий в бактериальной взвеси.
С помощью электронной микроскопии установлено, что культуры бифидобактерий, выращенных на соево-дрожжевой и казеиново-дрожжевых средах, не имеют морфологических различий и представлены в виде типичных слегка изогнутых палочек с булавовидными или шаровидными утолщениями на одном или двух концах.
Таким образом, экспериментально доказано, что разработанная соево-дрожжевая среда не уступает по эффективности регламентированной, более проста в изготовлении и экономична, что подтверждает целесообразность ее использования в производстве бифидумбактерина (табл. ).
).
Исследования по стабилизации бактериальной суспензии с использованием лиофилизации включали модификацию состава регламентированной защитной сахарозо-желатино-молочной среды.
Изменение состава ксеропротектора диктовалось необходимостью исключения или снижения коли-
чества дорогостоящих компонентов (желатин, сахароза), а также улучшения технологических свойств сухой биомассы.
При выпуске пробиотиков в виде дозированных порошков и капсул возникает ряд технологических проблем, связанных с высокой гигроскопичностью и низким показателем сыпучести сухой биомассы бифидобактерий. Для улучшения данных показателей была использована молочно-сахарозная среда со сниженным в 2 раза содержанием сахарозы по сравнению с сахарозо-желатино-молочной средой.
При оценке физико-химических и технологических свойств сухой микробной массы бифидобактерий, приготовленных на основе регламентированной защитной среды — сахарозо-желатино-молочной (СЖМ) и предлагаемой — сахарозо-молочной (СМ) среды. Установили, что исключение желатина не приводит к улучшению технологических свойств сухой микробной массы бифидобактерий.
Установили, что исключение желатина не приводит к улучшению технологических свойств сухой микробной массы бифидобактерий.
С учетом способности аэросила и геля алюминия гидроксида образовывать с водными растворами структурированные системы была исследована возможность введения их в состав ксеропротектора.
Для изучения влияния аэросила и геля алюминия гидроксида на биологические и технологические свойства сухой биомассы были апробированы различные варианты защитных сред.
В полученных образцах сухой микробной массы изучали показатели специфической активности -содержание количества КОЕ бифидобактерий и активность кислотообразования, интегральный параметр, который характеризует биохимическую и антагонистическую активность бифидобактерий.
Проведенные исследования показали, что введение в состав защитных сред дополнительных компонентов (аэросила и геля алюминия гидроксида) обеспечивает высокую выживаемость бифидобактерий при лиофильном высушивании. КОЕ/мл
КОЕ/мл
Соево-дрожжевая 14,0±1,0 0,296±0,03# 2,39±0,25# 75,38±2,55# 9,54±0,13#
Казеиново-дрожжевая (контроль) 14,0±1,0 0,287±0,02 2,43±0,20 74,91±2,04 9,52±0,13
Примечание: # р>0,05 по отношению к казеиново-дрожжевой среде (контроль).
на бифидобактерии, является иммобилизация клеток, в том числе на геле алюминия гидроксида.
Для изучения устойчивости к биологическим жидкостям лиофилизатов бифидобактерий были отобраны образцы, содержащие в своем составе гель алюминия гидроксида.
Результаты исследований свидетельствуют о высокой чувствительности неиммобилизованных бифидобактерий к действию желудочного сока и желчи. Так, после двухчасового контакта с желудочным соком содержание живых бифидобактерий в биомассе закономерно снижалось не менее чем на пять порядков. Снижение выживаемости на три порядка было выявлено при исследовании действия желчи.
При изучении выживаемости бифидобактерий, иммобилизованных на геле алюминия гидроксида, была установлена их выраженная устойчивость к действию желудочного сока и желчи. После двухчасового контакта с желудочным соком и желчью исходное содержание жизнеспособных бактерий в экспериментальных образцах снижалось не более чем на один порядок (рис. 2).
составы
состав 1 — бактериальная взвесь с ГАГ в соотношении (1:1) с СЖМ ср.; состав 2 — бактериальная взвесь с ГАГ в соотношении (1:0,5) с СЖМ ср.; состав 3 — бактериальная взвесь с ГАГ в соотношении (1:0,2) с СЖМ ср.; состав 4 — бактериальная взвесь с ГАГ в соотношении (1:0,2) с СЖМ ср.
+ 3% аэросила;
состав 5 — бактериальная взвесь с ГАГ в соотношении (1:0,2) с СМ ср.; состав 6 — бактериальная взвесь с ГАГ в соотношении (1:0,5) с СМ ср.; контроль — бактериальная взвесь с СЖМ ср.
■ исходное содержание жизнеспособных клеток
■ количество жизнеспособных клеток после экспозиции в желчи
□ количество жизнеспособных клеток после экспозиции в желудочном соке
Рис. 2. Сохранение выживаемости бифидобактерий при воздействии желудочного сока и желчи
Результаты данного этапа исследования показали, что все изученные составы лиофилизатов бифидобактерий с различными составами защитных сред, соответствуют регламентированным требованиям по основным биологическим показателям.
Иммобилизация бактериальных клеток на микроносителе — геле алюминия гидроксида — повышает устойчивость лиофилизатов бифидобактерий к действию желудочного сока и желчи, что свидетельствует о перспективности разработки технологии лекарственных форм на его основе.
Технологические свойства лиофилизатов бифидобактерий изучали по следующим показателям: сыпучести, насыпной плотности, гигроскопичности.
Установлено, что введение в состав СЖМ защитной среды геля алюминия гидроксида и аэросила фактически не улучшает технологических свойств сухой биомассы. Повышение показателей сыпучести и насыпной плотности отмечено для составов с гелем алюминия гидроксида, которые не содержат желатина.
По совокупности результатов исследований для дальнейшего изучения отобраны именно эти варианты сухой биомассы, приготовленной с применением СМ среды и геля алюминия гидроксида.
Производство порошков и капсул связано с выполнением технологических стадий смешивания и объемного дозирования.
Для повышения технологических свойств нами проведен подбор вспомогательных веществ — влаго-регуляторов, обеспечивающих снижение гигроскопичности и улучшение сыпучести сухой биомассы бифидобактерий.
В качестве вспомогательных веществ использовали: лактозу, аэросил, микрокристаллическую целлюлозу, композиции — и магния оксида с крахмалом, и лактозу с аэросилом. Образцом сравнения служила сухая микробная биомасса бифидобактерий, приготовленная с добавлением СМ-среды.
При оценке гигроскопичности установили, что наименьшие показатели прироста соответствуют лактозе, а также композии лактозы с аэросилом.
Для изучения влияния лактозы и аэросила на технологические свойства лиофилизат бифидобактерий смешивали в различных соотношениях с этими веществами до получения однородной порошкообразной массы.
Полученные результаты показывают, что на сыпучесть и влагопоглощение порошков существенно влияет содержание аэросила. Наиболее оптимальным по технологическим свойствам является состав, содержащий аэросила — 3%, соотношение бифидум-бактерина и лактозы (2:1) и состав — аэросила — 1% при соотношении бифидумбактерина и лактозы (1:2) (рис. 3).
Для определения концентрации аэросила, которая бы позволяла бы получать сыпучую, не отсыре-вающуюся и не уплотняющуюся в процессе хранения смесь, было изучено влияние разных концентраций
Содержание аэросила, %
Рис. 3. Зависимость влагопоглощения лиофилизата бифидобактерий с лактозой в соотношении 2:1 от концентрации аэросила
Существующая технология
ТТП-2.3. Приготовление гидролизата
ПР-1. Санитарная подготовка производства
ТП-3-2. Приготовление казеиноводрожжевой среды
ТП-2. Приготовление полуфабрикатов для питательных
ТП-3-3. Приготовление сахарозо-желатиново-молочной среды
ТП-3. Приготовление питательных и защитных сред
ТО-5-3. Выращивание производственной культуры бифидобактерий
ТП-4. Получение маточной культуры бифидобактерий
ТО-6-1. Розлив полуфабриката в кассеты
ТО-6-1. Розлив полуфабриката в кассеты
ТО-6-1. Розлив полуфабриката в кассеты
ТП-6. Розлив бифидумбакте-рина во флаконы
ТП-5. Культивирование бифидобактерий и получение
ТП-7. Высушивание бифидум-бактерина во флаконах методом сублимации
ТП-8. Маркировка, упаковка и хранение готового препарата
Разработанная технология
ТП-2.3. Приготовление соевого бульона из соевой муки , 2 ч
ТП-3-2. Приготовление соеводрожжевой среды
ТП-3-3. Приготовление молочно-дрожжевой среды (флаконы)
ТП-3.3. Приготовление сахарозо-молочной среды (пакеты, капсулы)
ТО-5.3. Выращивание производственной культуры бифидобактерий
ТП-6. Получение СБ бифидобактерий
ТП-7. Подготовка и расфасовка порошка бифидобактерий в капсулы
+ —-
ТО-6-1.Розлив полуфабриката в
ТО-6-2. Замораживание
ТО-6.3. Лиофилизация
ТО-6.4. Сбор и хранение СБ бифидобактерий
ТО-7-1. Размельчение СБ бифидобактерий и введение наполнителя
ТО-7-2. Расфасовка в пакеты или капсулы
Рис. 4. Технологическая схема производства препаратов на основе бифидобактерий
аэросила на сыпучесть лиофилизированного порошка бифидумбактерина с лактозой.
При этом удовлетворительную сыпучесть показал бифидумбактерин с лактозой в соотношении 1:2, содержащий 1% аэросила. При изучении влагосорбционных свойств установлено, что содержание аэросила в количестве 1% способствует снижению вла-гопоглощения. Увеличение содержание аэросила (более 1%) приводит к увеличению гигроскопичности материала.
Таким образом, в результате изучения модельных порошков бифидумбактерина по показателям сыпучести, насыпной плотности и гигроскопичности было установлено, что наиболее оптимальными технологическим характеристиками обладает смесь лиофилизата бифидобактерий и лактозы в соотношении (1:2) c добавлением 1% аэросила от общей массы порошка. Указанный состав был выбран в качестве производственного варианта при получении дозированных порошков и капсул. С учетом специфической активности бифидобактерий доза порошка в 1 пакете (капсуле) составила 0,35 г.
Результаты проведенных экспериментов использовали при разработке технологических схем производства дозированных порошков бифидумбактери-на в пакетах и капсулах. На рисунке 4 представлены схемы производства пероральных дозированных препаратов бифидумбактерина по существующей и предлагаемой технологиям.
Новая технология предусматривает использование в производстве экономичной соево-дрожжевой среды для выращивания бифидобактерий и С-среды
для стабилизации суспензии. Выращивание производственной культуры бифидобактерий в условиях периодического управляемого рН-статируемого культивирования позволяет получать нативную бактериальную взвесь с активностью 4-6х109 КОЕ/мл. 1 литр такой бактериальной взвеси соответствует 625 дозам препарата. Выполнение технологических операций, связанных с получением дозированных порошков в пакетах и капсулах, предусматривает использование представленных в настоящей работе технологических решений.
ВЫВОДЫ
1. На основании изученных закономерностей развития популяции штамма Bifidobacterium bifi-dum 1 определена оптимальная продолжительность (12-14 часов) процесса управляемого рН-статируе-мого периодического культивирования в биореакторе для получения биомассы бифидобактерий с максимальным содержанием жизнеспособных клеток.
2. Разработан состав и способ получения питательной среды, содержащей соевый бульон и дрожжевой аутолизат. Обоснована возможность ее использования для выращивания бифидобактерий в производственных условиях.
3. При изучении влияния природы ксеропротек-торов на биологические и технологические параметры лиофилизированной биомассы бифидобактерий предложен вариант сахарозо-молочной сред для получения пероральных лекарственных форм бифи-думбактерина. Разработан способ получения ацидо-резистентной лиофилизированной биомассы бифи-
добактерий, иммобилизованной на геле алюминия гидроксида, для использования в технологии дозированных порошков.
4. Экспериментально обоснован состав наполнителей для лиофилизата бифидобактерий, позволяющий получать порошок для дозирования в пакеты и капсулы, обладающий низкой гигроскопичностью следующего состава: сухая биомасса бифидобактерий — 0,117 г, лактоза — 0,230 г, аэросил — 0,003 г.
ЛИТЕРАТУРА
1. Семченко А.В. Перспективные направления создания пробиотических препаратов/ А.В. Семченко, Ю.И. Гришина, И.В. Красильников. // Материалы Всеросс. кон-фер. «Создание и перспективы применения медицинских иммунобиологических препаратов». — Пермь, 2008. — С. 185.
2. Ждан-Пушкина С.М. Основы роста культур микроорганизмов/ С.М. Ждан-Пушкина — Л.: Изд-во Ленинградского университета, 1983. — 187 с.
3. Несчисляев В.А. Изучение устойчивости лакто- и бифидобактерий к биологическим жидкостям / В.А. Несчисляев, И.В. Фадеева, В.Б. Моховикова // Материалы Всеросс. конфер. «Актуальные вопросы разработки, производства и применение иммунобиологических и фармацевтических препаратов». — Томск, 2004. — С. 130.
TECHNOLOGIC ASPECTS OF BIFIDUMBACTERIN PRODUCTION
M.I. Demesheva, L.N. Mezentseva, T.D. Limareva, Ye.V. Knyazyuk
SUMMARY
Mechanism of development of bacteria strain of Bifidobacterium bifidum 1 was investigated. Composition and method to prepare the nutrient medium consisting of soya broth and yeast autolysate as well as method to prepare acid-fast frozen-dried biomass of bifidobacterium immobilized on aluminium hydroxide gel were developed. Optimal stuff was experimentally established to be lactose, humidistat to be aerosil which allow to obtain homogeneous mixture for filling.
Key words: dysbacteriosis, bifidumbacterin, technology, capsules, drug forms.
Бифидумбактерин Диамед 2,5% с бифидобактериями 190 мл
- Рекомендованный возраст: с 6 мес.
- Объем: 190 мл
Кисломолочный Бифидумбактерин – продукт жирностью 2,5%.
Состав и вкус продукта: молоко коровье цельное, закваска из чистых штаммов бифидобактерий. Закваска состоит из нескольких штаммов Bifidum longum, Bifidum adolescentis, Bifidum bifidum, которые чаще всего встречаются в организме человека. По вкусу он напоминает ряженку со слабым очень рыхлым сгустком. Иногда сгустка ярко выраженного может и не быть и это не порок продукта. Просто, бифидобактерии настолько нежные микроорганизмы, что на них повлиять может и атмосферное давление, и даже то, с каким настроением с ними работал микробиолог. Но пользу они приносят однозначно и очень быстро.
Показания к применению: Если ребенок находится на искусственном вскармливании, то продукт можно начинать давать по чайной ложке до кормления, постепенно увеличивая дозу до 10 — 20 мл 2 раза в день. Для взрослого человека, минимальное количество продукта 100 мл 2 раза в день натощак или до еды. Очень благоприятен продукт кормящим мамам, спортсменам, людям ведущим здоровый образ жизни. Для спортсменов он просто необходим. При повышенных нагрузках токсины выбрасываются в кровь, и чтобы с этим справится, на помощь приходят бифидобактерии. Именно они способствуют выведению токсинов. Людям, страдающим диабетом, кисломолочный бифидумбактерин помогает нормализовать пищеварение, и опосредованно влияет на уровень сахара в крови.
Противопоказания возникают для людей с полной лактазной недостаточностью, непереносимостью белков коровьего молока.
Внимание! Так как продукт содержит живые микроорганизмы, он требует температурного режима хранения +2±40С. При частом встряхивании и интенсивном взбалтывании может происходить отделение сыворотки, но это никак не вредит продукту, нарушается его внешний вид, а бактерии остаются живыми до 30-50 дней.
Продукт без заменителя молочного жира.
Бифидумбактерин для Новорожденных (и Грудничков!)
Опытные мамы и папы уверяют, что Бифидумбактерин для новорожденных и грудничков является эффективным и проверенным средством в борьбе с коликами и вздутием живота. Безопасно ли это средство, и как давать Бифидумбактерин грудничку?
Содержание:
Работа желудочно-кишечного тракта у младенца
Чем полезен Бифидумбактерин детям
В какой форме давать Бифидумбактерин грудничкам
Бифидумбактерин или Бифидумбактерин Форте для новорожденных — что лучше?
Бифидумбактерин: инструкция для новорожденных
Сухой Бифидумбактерин — как разводить?
Противопоказания
Кишечник едва родившегося младенца – это воплощение чистоты, совершенная медицинская стерильность. В нем пока не содержатся ни «плохие», ни «хорошие» бактерии, помогающие переваривать пищу. Первые микроорганизмы ребенок получает только с материнским молоком, но зачастую их оказывается недостаточно.
Когда бактерий в организме слишком мало, организм не успевает справляться с поступающей в него пищей, и у малыша начинаются проблемы с работой ЖКТ, появляются колики и дисбактериоз.
В этом случае бифидобактерии для новорожденных становятся средством спасения. Это микроскопические живые организмы, идентичные бактериям, которые содержатся в кишечнике человека – попадая в организм младенца, они налаживают работу желудочно-кишечного тракта. Давайте разберемся, как они работают и зачем нужны?
Работа желудочно-кишечного тракта у младенца
Значимость правильной работы пищеварительной системы в целом и кишечника в частности невозможно переоценить. Большинство питательных веществ усваивается именно там – поэтому, когда кишечник работает неправильно, и организму не хватает энергии, плохое настроение, слабость и недомогания обеспечены.
Не обошло это стороной и новорожденных – для едва родившихся малышей правильная работа ЖКТ важна ничуть не меньше, чем для взрослых! При малейших сбоях в его работе у младенца появятся вздутия и колики, что доставляет много беспокойства и ему, и его родителям.
Работа желудочно-кишечного тракта строится на взаимодействии бактерий. Поступая в организм с молоком матери, полезные бактерии формируют колонии и защищают место своего обитания от незваных гостей: они обволакивают кишечник защитной пленкой, способствующей правильной работе кишечника, и помогают формировать нервные окончания для приема иной пищи, кроме молока или детской смеси.
Однако, когда полезных бактерий в организме оказывается недостаточно, у малыша начинаются спазматические колики. Поступившая в организм пища не успевает перерабатываться целиком, начинает бродить и выделять газовые пузырьки, вызывая болезненную реакцию.
Важно, чтобы бактерий в кишечнике ребенка было достаточно: малейшая их нехватка приведет к спазмам, авитаминозу, дисбактериозу и другим неприятным состояниям, которые придется лечить.
Деятельность желудочно-кишечного тракта отражается на всем организме маленького человека, поэтому правильная его работа – залог здоровья вашего малыша. И, когда полезных бактерий в нем оказывается недостаточно, Бифидумбактерин для новорожденных и грудничков – первый помощник. В качестве активного компонента препарата выступает бифидобактерия бифидум.
Чем полезен Бифидумбактерин детям
Этот замечательный препарат с бифидобактериями в основе станет настоящим спасением для малыша, имеющего проблемы с пищеварительной системой. Живые микроорганизмы в его составе, идентичны полезным бактериям в кишечнике человека, при попадании в организм начнут выполнять их функцию: застилать кишечник защитной пленкой, развивать нервные окончания для усваивания полезных веществ, бороться с болезнетворными микроорганизмами.
Препарат Бифидумбактерин быстро устранит большинство проблем, возникающих в ЖКТ малютки: дисбактериоз, колики, нехватку питательных веществ, способную даже привести к рахиту. Не менее полезно будет назначение такого препарата малышам с анемией и диатезом, а также детям, переходящим на новое питание: к примеру, с грудного молока на детскую смесь.
Однако важно отметить, что бактерии бифидум для новорожденных и грудничков не стоит использовать в качестве профилактики: препарат назначает исключительно педиатр при серьезных отклонениях в работе желудочно-кишечного тракта, когда неправильная работа микроорганизмов становится причиной болезней и недомогания.
Назначать Бифидумбактерин для детей самостоятельно нельзя!
Если у вашего малыша все в порядке с полезными бактериями, а вы станете давать ему препарат, то это может спровоцировать дисбактериоз именно их перенасыщением.
Бифидумбактерин, помимо бифидобактерий в составе, может также оказывать антибактериальное воздействие на болезнетворные бактерии. Таким образом, этот препарат не только нормализует работу желудочно-кишечного тракта, а еще и восстанавливает иммунитет.
В какой форме давать Бифидумбактерин грудничкам
Препарат выпускается в нескольких разных формах:
- сухой Бифидумбактерин – порошок во флаконах и фольгированных пакетиках;
- жидкий Бифидумбактерин в ампулах;
- в капсулах;
- в таблетках;
- свечи Бифидумбактерин.
Для новорожденных и грудных детей рекомендуется использовать препарат Бифидумбактерин детский, произведенный в жидком виде, а так же в виде порошков или свечей.
Бифидумбактерин или Бифидумбактерин Форте для новорожденных — что лучше?
Бифидумбактерин Форте считается улучшенным лекарственным препаратом.
Он отличается биомассой живых бифидобактерий, адсорбированных на косточковом активированном угле. Это позволяет препарату, попав в кишечник, действовать быстрее.
Поэтому, несомненно, при серьезных заболеваниях лучше использовать Бифидумбактерин форте.
Бифидумбактерин: инструкция для новорожденных
Конечно же, Бифидумбактерин новорожденным и грудничкам должен назначаться сугубо индивидуально, в зависимости от того, в каком состоянии сейчас находится пищеварительная система младенца: за этим должен следить педиатр. Его же задача назначать подходящую схему приема.
В зависимости от состояния ребенка врач может назначить от 2 до 5 доз 1-3 раза в сутки. Длительность курса – до 21 дня, возможен повтор через 1 месяц.
Родителям следует знать, что в таблетке и свече содержится по 1 дозе препарата, остальные формы препарата содержат по 5 доз.
Желательно принимать лекарство за полчаса до еды, либо спустя 1 час после. То есть препарат для достижения максимальной эффективности нужно пить на пустой желудок. В случае с младенцами добиться этого достаточно сложно. Поэтому допустимо разводить Бифидумбактерин для новорожденных молоком. Грудничкам, находящимся на искусственном вскармливании, порошок Бифидумбактерин можно добавлять и разводить вместе с порошковыми смесями.
Сухой Бифидумбактерин — как разводить?
Порошок следует высыпать в небольшую емкость, затем добавить кипяченую воду из расчета 5 мл на 1 дозу (один пакетик содержит 5 доз). Средство необходимо тщательно перемешать, выждать около 10 минут для максимального растворения (препарат полностью не растворяется).
Приготовленный раствор хранению не подлежит (бифидобактерии в нем быстро погибают), а вот оставшуюся нерастворенной часть порошка можно хранить, но не более суток.
Противопоказания
Бифидумбактерин для грудничков и новорожденных в допустимых инструкциях дозах совершенно не опасен, поскольку не имеет никаких побочных действий и противопоказаний. Но есть оно «НО!». Возможна аллергическая реакция на один из компонентов препарата.
Если у вашего малыша есть непереносимость какого-либо из следующих веществ, воздержитесь от приема и проконсультируйтесь о замене препарата с педиатром:
- лактоза;
- крахмал высушенный;
- стеарат кальция.
Если вы не знали об аллергии у своего малыша на указанные компоненты, но обнаружили у него усиленное вздутие или колики после приема, иные проявления аллергической реакции, прекратите применение Бифидумбактерина немедленно. Существуют аналоги этого препарата, не содержащие в составе этих веществ – можете попробовать принимать их.
Правильная работа желудочно-кишечного тракта младенца – это очень важно. Если не помогать ребенку вовремя, страдания в младенческом возрасте могут обратиться проблемами с пищеварением во взрослом: поэтому, если вашему ребенку не хватает полезных бактерий, смело применяйте Бифидумбактерин, но предварительно проконсультируйтесь со специалистом.
Как принимать Бифидумбактерин
Обзор, применение, побочные эффекты, меры предосторожности, взаимодействия, дозировка и отзывы
Sadeghi-Bojd S, Naghshizadian R, Mazaheri M, Ghane Sharbaf F, Assadi F. Эффективность пробиотической профилактики после первой лихорадочной инфекции мочевыводящих путей у детей с нормальным здоровьем. мочевыводящие пути. J Pediatric Infect Dis Soc. 2020; 9 (3): 305-310. Просмотреть аннотацию.
Сато С., Учида Т., Кувана С. и др. Бактериемия, вызванная Bifidobacterium breve у новорожденного с экстрофией клоаки. Pediatr Int. 2016; 58 (11): 1226-8.Просмотреть аннотацию.
Saxelin M, Chuang NH, Chassy B и др. Лактобациллы и бактериемия на юге Финляндии 1989-1992 гг. Clin Infect Dis 1996; 22: 564-6. Просмотреть аннотацию.
Scarpignato C, Rampal P. Профилактика и лечение диареи путешественников: клинический фармакологический подход. Химиотерапия 1995; 41: 48-81. Просмотреть аннотацию.
Шмидт Р.М., Пилманн Лаурсен Р., Бруун С. и др. Пробиотики в позднем младенчестве снижают частоту возникновения экземы: рандомизированное контролируемое исследование. Pediatr Allergy Immunol.2019; 30 (3): 335-340. Просмотреть аннотацию.
Шариф А, Кашани Х. Х., Насри Э, Сулеймани З., Шариф MR. Роль пробиотиков в лечении дизентерии: рандомизированное двойное слепое клиническое испытание. Пробиотики, антимикробные белки. 2017; 9 (4): 380-385. Просмотреть аннотацию.
Shavakhi A, Tabesh E, Yaghoutkar A, Hashemi H, Tabesh F, Khodadoostan M, Minakari M, Shavakhi S, Gholamrezaei A. Влияние пробиотического соединения с множеством штаммов на висмутсодержащую четырехкомпонентную терапию для инфекции Helicobacter pylori — рандомизированное контролируемое тройное слепое исследование.Helicobacter. 2013; 18 (4): 280-4. Просмотреть аннотацию.
Шэнь Дж., Цзо З.С., Мао А.П. Влияние пробиотиков на вызывание ремиссии и поддерживающую терапию при язвенном колите, болезни Крона и поучите: метаанализ рандомизированных контролируемых исследований. Воспаление кишечника. 2014; 20 (1): 21-35. Просмотреть аннотацию.
Симрен М., Оман Л., Олссон Дж. И др. Клиническое испытание: влияние ферментированного молока, содержащего три пробиотических бактерии, на пациентов с синдромом раздраженного кишечника — рандомизированное двойное слепое контролируемое исследование.Алимент Фармакол Тер 2010; 31 (2): 218-27. Просмотреть аннотацию.
Сликерман Р.Ф., Кан Дж., Ван Зил Н. и др. Влияние раннего приема пробиотиков на познавательные способности, поведение и настроение в детстве — рандомизированное плацебо-контролируемое исследование. Acta Paediatr. 2018; 107 (12): 2172-2178. Просмотреть аннотацию.
Сёндергаард Б., Олссон Дж., Олсон К., Свенссон Ю., Битцер П., Экесбо Р. Влияние пробиотической ферментированного молока на симптомы и кишечную флору у пациентов с синдромом раздраженного кишечника: рандомизированное плацебо-контролируемое исследование.Сканд Дж. Гастроэнтерол 2011; 46 (6): 663-72. Просмотреть аннотацию.
Staudacher HM, Lomer MCE, Farquharson FM, et al. Диета с низким содержанием FODMAP уменьшает симптомы у пациентов с синдромом раздраженного кишечника, а пробиотик восстанавливает виды Bifidobacterium: рандомизированное контролируемое исследование. Гастроэнтерология. 2017; 153 (4): 936-947. Просмотреть аннотацию.
Стенман Л.К., Лехтинен М.Дж., Меланд Н. и др. Пробиотик с клетчаткой или без нее, связанный с сывороточным зонулином, контролирует жировую массу в рандомизированном контролируемом исследовании взрослых с избыточным весом и ожирением.EBioMedicine 2016; 13: 190-200. Просмотреть аннотацию.
Салливан А, Баркхольт Л, Север СЕ. Lactobacillus acidophilus, Bifidobacterium lactis и Lactobacillus F19 предотвращают связанные с антибиотиками экологические нарушения Bacteroides fragilis в кишечнике. Журнал Antimicrob Chemother 2003; 52: 308-11. Просмотреть аннотацию.
Табберс М.М., Миллиано I, Роузбум М.Г., Беннинга М.А. Эффективны ли Bifidobacterium breve при лечении запоров у детей? Результаты пилотного исследования. Нутр Ж 2011; 10:19.Просмотреть аннотацию.
Tomasz B, Zoran S, Jaroslaw W, Ryszard M, Marcin G, Robert B, Piotr K, Lukasz K, Jacek P, Piotr G, Przemyslaw P, Michal D. Долгосрочное использование пробиотиков Lactobacillus и Bifidobacterium имеет профилактическое действие влияние на возникновение и тяжесть поучита: рандомизированное проспективное исследование. Biomed Res Int. 2014; 2014: 208064. Просмотреть аннотацию.
Tursi A, Brandimarte G, Giorgetti GM, et al. Низкие дозы бальсалазида в сочетании с сильнодействующим пробиотическим препаратом более эффективны, чем один бальсалазид или месалазин при лечении острого язвенного колита легкой или средней степени тяжести.Med Sci Monit 2004; 10: PI126-31. Просмотреть аннотацию.
Вентури А., Джиончетти П., Риццелло Ф. и др. Влияние нового пробиотического препарата на состав фекальной флоры: предварительные данные по поддерживающей терапии больных язвенным колитом. Aliment Pharmacol Ther 1999; 13: 1103-8. Просмотреть аннотацию.
Videlock EJ, Cremonini F. Мета-анализ: пробиотики при диарее, связанной с антибиотиками. Алимент Pharmacol Ther. 2012; 35 (12): 1355-69. Просмотреть аннотацию.
Ван Г, Фэн Д.Терапевтический эффект Saccharomyces boulardii в сочетании с Bifidobacterium и на клеточную иммунную функцию у детей с острой диареей. Exp Ther Med. 2019; 18 (4): 2653-2659. Просмотреть аннотацию.
Ван Ю. Х., Хуанг Ю. Влияние добавок Lactobacillus acidophilus и Bifidobacterium bifidum к стандартной тройной терапии на эрадикацию Helicobacter pylori и динамические изменения кишечной флоры. Мир J Microbiol Biotechnol. 2014; 30 (3): 847-53. Просмотреть аннотацию.
Ван Чж, Гао Цюй, Фан Цзюй.Метаанализ эффективности и безопасности препаратов пробиотических соединений, содержащих лактобактерии и бифидобактерии, в эрадикационной терапии Helicobacter pylori. J Clin Gastroenterol. 2013; 47 (1): 25-32. Просмотреть аннотацию.
Whorwell PJ, Altringer L, Morel J, et al. Эффективность инкапсулированного пробиотика Bifidobacterium infantis 35624 у женщин с синдромом раздраженного кишечника. Am J Gastroenterol. Июль 2006; 101 (7): 1581-90. Просмотреть аннотацию.
Wildt S, Nordgaard I, Hansen U, Brockmann E, Rumessen JJ.Рандомизированное двойное слепое плацебо-контролируемое исследование с Lactobacillus acidophilus La-5 и Bifidobacterium animalis subsp. lactis BB-12 для поддержания ремиссии при язвенном колите. J. Crohns Colitis 2011; 5 (2): 115-21. Просмотреть аннотацию.
Wu G, Chen X, Cui N, et al. Профилактическое действие добавок Bifidobacterium на неонатальный холестаз у недоношенных новорожденных с очень низкой массой тела при рождении. Гастроэнтерол Рес Прак. 2020; 2020: 4625315. Просмотреть аннотацию.
Сяо Дж., Кацумата Н., Бернье Ф. и др.Пробиотик bifidobacterium breve в улучшении когнитивных функций у пожилых людей с подозрением на легкие когнитивные нарушения: рандомизированное двойное слепое плацебо-контролируемое исследование. J. Alzheimers Dis. 2020; 77 (1): 139-147. Просмотреть аннотацию.
Сяо Дж.З., Такахаши С., Одамаки Т. и др. Чувствительность к антибиотикам штаммов бифидобактерий, распространенных на японском рынке. Biosci Biotechnol Biochem. 2010; 74 (2): 336-42. Просмотреть аннотацию.
Замани Б., Голкар Х.Р., Фаршбаф С. и др. Клинический и метаболический ответ на добавление пробиотиков у пациентов с ревматоидным артритом: рандомизированное двойное слепое плацебо-контролируемое исследование.Int J Rheum Dis 2016; 19 (9): 869-79. Просмотреть аннотацию.
Акацу, Х., Ивабути, Н., Сяо, Дж. З., Мацуяма, З., Курихара, Р., Окуда, К., Ямамото, Т., и Маруяма, М. Клинические эффекты пробиотических бактерий Bifidobacterium longum BB536 на иммунную систему. Функция и кишечная микробиота у пожилых пациентов, получающих энтеральное зондовое питание. JPEN J Parenter Enteral Nutr 11-27-2012; Просмотреть аннотацию.
Андраде, С. и Борхес, Н. Влияние ферментированного молока, содержащего Lactobacillus acidophilus и Bifidobacterium longum, на липиды плазмы женщин с нормальным или умеренно повышенным холестерином.J.Dairy Res. 2009; 76 (4): 469-474. Просмотреть аннотацию.
Арая-Кодзима Томоко, Яэшима Томоко Исибаши Норио Симамура Сейичи Хаясава Хиротоши. Ингибирующее действие Bifidobacterium longum BB536 на вредные кишечные бактерии. Бифидобактерии Microflora 1995; 14 (2): 59-66.
Баллонг Дж., Гриль Дж. Барат-Евлог П. Действие по цвету кишечных ферментов с бифидобактериями. Lait 1993; 73: 249-256.
Беннет Р., Норд К. Э. и Зеттерстром Р. Временная колонизация кишечника новорожденных младенцев перорально вводимыми бифидобактериями и лактобактериями.Acta Paediatr. 1992; 81 (10): 784-787. Просмотреть аннотацию.
Chouraqui, JP, Grathwohl, D., Labaune, JM, Hascoet, JM, de, Montgolfier, I, Leclaire, M., Giarre, M., and Steenhout, P. Оценка безопасности, переносимости и защитного эффекта против диареи смесей для младенцев, содержащих смеси пробиотиков или пробиотиков и пребиотиков, в рандомизированном контролируемом исследовании. Am.J Clin.Nutr. 2008; 87 (5): 1365-1373. Просмотреть аннотацию.
Дас Р.Р. Сингх М., Шафик Н. Пробиотики в лечении аллергического ринита.Журнал Всемирной организации аллергии 2010; 3 (9): 239-244.
del Giudice, M. M. и Brunese, F. P. Пробиотики, пребиотики и аллергия у детей: что нового за последний год? J Clin.Gastroenterol. 2008; 42 Приложение 3, часть 2: S205-S208. Просмотреть аннотацию.
Dimidi E, Zdanaviciene A, Christodoulides S, et al. Рандомизированное клиническое испытание: пробиотик Bifidobacterium lactis NCC2818 по сравнению с плацебо и влияние на время прохождения через кишечник, симптомы и микробиологию кишечника при хроническом запоре. Алимент Pharmacol Ther.2019; 49 (3): 251-264. Просмотреть аннотацию.
Фирмансьях, А., Двапурванторо, П.Г., Кадим, М., Алатас, С., Конус, Н., Лестарина, Л., Буиссе, Ф., и Стинхаут, П. Улучшение роста малышей, которых кормили молоком, содержащим синбиотики . Азия Pac.J Clin.Nutr. 2011; 20 (1): 69-76. Просмотреть аннотацию.
Джанотти, Л., Морелли, Л., Гальбиати, Ф., Роккетти, С., Коппола, С., Бенедуче, А., Джилардини, К., Зоненсчейн, Д., Несполи, А., и Брага, M. Рандомизированное двойное слепое исследование периоперационного введения пробиотиков пациентам с колоректальным раком.Мир Дж. Гастроэнтерол. 1-14-2010; 16 (2): 167-175. Просмотреть аннотацию.
Hascoet, J.M., Hubert, C., Rochat, F., Legagneur, H., Gaga, S., Emady-Azar, S., и Steenhout, P.G. Влияние состава смеси на развитие микробиоты кишечника младенцев. J Педиатр, гастроэнтерол, питание. 2011; 52 (6): 756-762. Просмотреть аннотацию.
Игараси М., Иияма И Като Р. Томита М. Асами Н. Эзава И. Влияние Bifidobacterium longum и лактулозы на прочность кости в моделях остеопороза после овариэктомии.Бифид 1994; 7: 139-147.
Ивабучи Н., Хирута Н. Канетада С. Яешима Т. Ивацуки К. Ясуи Х. Эффекты интраназального введения Bifidobacterium longum BB536 на иммунную систему слизистой оболочки дыхательных путей и вирусную инфекцию гриппа у мышей. Наука о молоке 2009; 38 (3): 129-133.
Ивабучи, Н., Такахаши, Н., Сяо, Дж. З., Мияджи, К., и Ивацуки, К. In vitro Th2-независимые цитокин-независимые Th3 подавляющие эффекты бифидобактерий. Microbiol.Immunol. 2007; 51 (7): 649-660. Просмотреть аннотацию.
Ивабути, Н., Такахаши, Н., Сяо, Дж. З., Йонедзава, С., Яэшима, Т., Ивацуки, К., и Хачимура, С. Подавляющее действие Bifidobacterium longum на производство Th3-привлекающих хемокинов индуцировало с взаимодействиями Т-лимфоцитов с антиген-презентирующими клетками. FEMS Immunol.Med.Microbiol. 2009; 55 (3): 324-334. Просмотреть аннотацию.
Iwabuchi, N., Xiao, J. Z., Yaeshima, T., and Iwatsuki, K. Пероральное введение Bifidobacterium longum уменьшает инфекцию вируса гриппа у мышей. Биол.Pharm.Bull. 2011; 34 (8): 1352-1355. Просмотреть аннотацию.
Кагеяма Т., Накано и Томода Т. Сравнительное исследование перорального приема некоторых препаратов бифидобактерий. Медицина и биология (Япония) 1987; 115 (2): 65-68.
Кагеяма Т., Томода Т. Накано Ю. Эффект введения бифидобактерий у пациентов с лейкемией. Бифидобактерии Microflora. 1984; 3 (1): 29-33.
Кондо, Дж., Сяо, Дж. З., Сирахата, А., Баба, М., Абэ, А., Огава, К., и Симода, Т. Модулирующие эффекты Bifidobacterium longum BB536 на дефекацию у пожилых пациентов, получающих энтеральное питание .Всемирный журнал J Gastroenterol 4-14-2013; 19 (14): 2162-2170. Просмотреть аннотацию.
Мацумото, Т., Исикава, Х., Татеда, К., Яэшима, Т., Ишибаши, Н. и Ямагути, К. Пероральное введение Bifidobacterium longum предотвращает вызванный кишечником сепсис Pseudomonas aeruginosa у мышей. J Appl.Microbiol. 2008; 104 (3): 672-680. Просмотреть аннотацию.
Намба К., Яешима Т. Исибаши Н. Хаясава Х и Ямадзаки Сёдзи. Подавляющее действие Bifidobacterium longum на энтерогеморрагическую Escherichia coli O157: H7. Биологическая микрофлора 2003; 22 (3): 85-91.
Намба К., Хатано М., Яешима Т., Такасе М. и Сузуки К. Влияние введения Bifidobacterium longum BB536 на гриппозную инфекцию, титр антител к вакцине против гриппа и клеточный иммунитет у пожилых людей . Biosci.Biotechnol.Biochem. 2010; 74 (5): 939-945. Просмотреть аннотацию.
Одамаки, Т., Сугахара, Х., Ёнэдзава, С., Яешима, Т., Ивацуки, К., Танабэ, С., Томинага, Т., Тогаши, Х., Бенно, Ю., и Сяо, JZ Влияние перорального приема йогурта, содержащего Bifidobacterium longum BB536, на количество клеток энтеротоксигенных Bacteroides fragilis в микробиоте.Анаэроб. 2012; 18 (1): 14-18. Просмотреть аннотацию.
Odamaki, T., Xiao, JZ, Iwabuchi, N., Sakamoto, M., Takahashi, N., Kondo, S., Iwatsuki, K., Kokubo, S., Togashi, H., Enomoto, T. , и Бенно, Ю. Колебания фекальной микробиоты у людей с поллинозом японского кедра во время сезона пыльцы и влияние приема пробиотиков. J Investig.Allergol.Clin.Immunol. 2007; 17 (2): 92-100. Просмотреть аннотацию.
Одамаки, Т., Сяо, Дж. З., Ивабучи, Н., Сакамото, М., Такахаши, Н., Кондо, С., Мияджи, К., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Влияние потребления Bifidobacterium longum BB536 на фекальную микробиоту у людей с поллинозом японского кедра в сезон пыльцы. J Med.Microbiol. 2007; 56 (Pt 10): 1301-1308. Просмотреть аннотацию.
Одамаки, Т., Сяо, Д.З., Сакамото, М., Кондо, С., Яешима, Т., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Распространение различных видов группы Bacteroides fragilis у лиц с поллинозом японского кедра.Appl.Environ.Microbiol. 2008; 74 (21): 6814-6817. Просмотреть аннотацию.
Огата Т., Кингаку М. Яэсима Т. Терагути С. Фукуватари и Ишибаши Н. Хаясава Х. Фудзисава Т. Лино Х. Влияние приема йогурта Bifidobacterium longum BB536 на кишечную среду здоровых взрослых. Microb Ecol Health Dis 1999; 11: 41-46.
Огата Т., Накамура Т. Анджитсу К. Яешима Т. Такахаши С. Фукуватари Й Ишибаши Н. Хаясава Х. Фудзисава Т. Иино Х. Влияние введения Bifidobacterium longum BB536 на кишечную среду, частоту дефекации и фекальные характеристики добровольцев.Biosci Microflora 1997; 16: 53-58.
Орраге, К., Шостедт, С., и Норд, С. E. Влияние добавок с молочнокислыми бактериями и олигофруктозой на микрофлору кишечника при введении цефподоксима проксетила. J Antimicrob.Chemother. 2000; 46 (4): 603-612. Просмотреть аннотацию.
Пуччио, Г., Кахоццо, К., Мели, Ф., Рошат, Ф., Гратволь, Д., и Стинхаут, П. Клиническая оценка новой закваски для младенцев, содержащей живые Bifidobacterium longum BL999 и пребиотики.Питание 2007; 23 (1): 1-8. Просмотреть аннотацию.
Редди Б. С. и Ривенсон А. Ингибирующее действие Bifidobacterium longum на канцерогенез толстой кишки, молочной железы и печени, индуцированное 2-амино-3-метилимидазо [4,5-f] хинолином, пищевым мутагеном. Cancer Res. 9-1-1993; 53 (17): 3914-3918. Просмотреть аннотацию.
Rouge, C., Piloquet, H., Butel, MJ, Berger, B., Rochat, F., Ferraris, L., Des, Robert C., Legrand, A., de la Cochetiere, MF, N ‘ Guyen, JM, Vodovar, M., Voyer, M., Darmaun, D., and Roze, J.C. Пероральный прием пробиотиков у недоношенных новорожденных с очень низкой массой тела при рождении: рандомизированное двойное слепое плацебо-контролируемое исследование. Am.J Clin.Nutr. 2009; 89 (6): 1828-1835. Просмотреть аннотацию.
Секи М., Игараси Т. Фукуда И Симамура С Касвашима Т. Огаса К. Влияние кисломолочного продукта Bifidobacterium на «регулярность» среди пожилых людей. Nutr Foodstuff 1978; 31: 379-387.
Sekine I, Yoshiwara S Homma N Takanori H Tonosuka S. Влияние молока, содержащего бифидобактерии, на хемилюминесцентную реакцию периферических лейкоцитов и средний корпускулярный объем эритроцитов — возможная роль Bifidobacterium в активации макрофагов.Therapeutics (Япония) 1985; 14: 691-695.
Simakachorn, N., Bibiloni, R., Yimyaem, P., Tongpenyai, Y., Varavithaya, W., Grathwohl, D., Reuteler, G., Maire, JC, Blum, S., Steenhout, P. , Benyacoub, J., и Schiffrin, EJ. Толерантность, безопасность и влияние на фекальную микробиоту энтеральной смеси, дополненной пре- и пробиотиками, у детей в критическом состоянии. J Педиатр, гастроэнтерол, питание. 2011; 53 (2): 174-181. Просмотреть аннотацию.
Сингх, Дж., Ривенсон, А., Томита, М., Шимамура, С., Ishibashi, N., and Reddy, B. S. Bifidobacterium longum, кишечная бактерия, продуцирующая молочную кислоту, ингибирует рак толстой кишки и модулирует промежуточные биомаркеры канцерогенеза толстой кишки. Канцерогенез 1997; 18 (4): 833-841. Просмотреть аннотацию.
Soh, SE, Aw, M., Gerez, I., Chong, YS, Rauff, M., Ng, YP, Wong, HB, Pai, N., Lee, BW, and Shek, LP Пробиотические добавки в первые 6 месяцев жизни у азиатских младенцев из группы риска — влияние на экзему и атопическую сенсибилизацию в возрасте 1 года.Клинический опыт аллергии 2009; 39 (4): 571-578. Просмотреть аннотацию.
Takeda, Y., Nakase, H., Namba, K., Inoue, S., Ueno, S., Uza, N., and Chiba, T. Улучшается регуляция T-bet и молекул плотных контактов с помощью Bifidobactrium longum воспаление толстой кишки при язвенном колите. Воспаление. 2009; 15 (11): 1617-1618. Просмотреть аннотацию.
Тан, М. Л., Лахтинен, С. Дж., И Бойл, Р. Дж. Пробиотики и пребиотики: клинические эффекты при аллергических заболеваниях. Curr.Opin.Pediatr. 2010; 22 (5): 626-634. Просмотреть аннотацию.
Томода Т., Накано Ю. Кагеяма Т. Разрастание кишечных Candida и кандидозная инфекция у пациентов с лейкемией: эффект от введения бифидобактерий. Бифидобактерии Microflora 1988; 7 (2): 71-74.
Томода Т., Накано Ю. Кагеяма Т. Изменения в небольших группах постоянной кишечной флоры во время приема противоопухолевых или иммунодепрессивных препаратов. Медицина и биология (Япония) 1981; 103 (1): 45-49.
Сяо Дж., Кондол С Одамаки Т Миядзи К Яешима Т Ивацуки К Тогаши Х Бенно Й.Влияние йогурта, содержащего Bifidobacterium longum BB 536, на частоту дефекации и фекальные характеристики здоровых взрослых: двойное слепое перекрестное исследование. Японский журнал молочнокислых бактерий 2007; 18 (1): 31-36.
Xiao, JZ, Kondo, S., Takahashi, N., Odamaki, T., Iwabuchi, N., Miyaji, K., Iwatsuki, K., and Enomoto, T. Изменения уровней TARC в плазме во время пыльцы японского кедра сезон и связь с развитием симптомов. Int.Arch.Allergy Immunol. 2007; 144 (2): 123-127.Просмотреть аннотацию.
Xiao, JZ, Kondo, S., Yanagisawa, N., Miyaji, K., Enomoto, K., Sakoda, T., Iwatsuki, K., and Enomoto, T. Клиническая эффективность пробиотика Bifidobacterium longum для лечения симптомов аллергии на пыльцу японского кедра у субъектов, оцениваемых в отделении воздействия окружающей среды. Аллергол. 2007; 56 (1): 67-75. Просмотреть аннотацию.
Сяо, Дж. З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Ивацуки, К., Кокубо, С., Тогаши, Х., Эномото, К.и Эномото Т. Эффект пробиотика Bifidobacterium longum BB536 [скорректированный] в облегчении клинических симптомов и модуляции уровней цитокинов в плазме поллиноза японского кедра во время сезона пыльцы. Рандомизированное двойное слепое плацебо-контролируемое исследование. J Investig.Allergol.Clin.Immunol. 2006; 16 (2): 86-93. Просмотреть аннотацию.
Сяо, Д.З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Миядзи, К., Ивацуки, К., Тогаши, Х., Эномото, К. и Эномото Т. Пробиотики в лечении поллиноза японского кедра: двойное слепое плацебо-контролируемое исследование.Клинический опыт аллергии 2006; 36 (11): 1425-1435. Просмотреть аннотацию.
Яешима Т., Такахаши С. Мацумото Н. Исибаши Н. Хаясава Х. Лино Х. Влияние йогурта, содержащего Bifidobacterium longum BB536, на кишечную среду, фекальные характеристики и частоту дефекации: сравнение со стандартным йогуртом. Biosci Microflora 1997; 16: 73-77.
Яешима Т., Такахаши С Огура А Конно Т. Ивацуки К. Исибаши Н. Хаясава Х. Влияние неферментированного молока, содержащего Bifidobacterium longum BB536, на частоту дефекации и характеристики кала у здоровых взрослых.Журнал Nutrition Food 2001; 4 (2): 1-6.
Яешима Т., Такахаси С Ота С. Накагава К. Ишибаши Н Хирамацу А Охаши Т. Хаясава Х Иино Х. Влияние сладкого йогурта, содержащего Bifidobacterium longum BB536, на частоту дефекации и фекальные характеристики здоровых взрослых людей: сравнение со сладким стандартным йогуртом. Kenko Eiyo Shokuhin Kenkyu 1998; 1 (3/4): 29-34.
Ямазаки, С., Мачии, К., Цуюки, С., Момосе, Х., Кавашима, Т. и Уэда, К. Иммунологические реакции на моноассоциированные Bifidobacterium longum и их связь с предотвращением бактериальной инвазии.Иммунология 1985; 56 (1): 43-50. Просмотреть аннотацию.
Зивковиц, М., Фекаду, К., Зонтаг, Г., Набингер, У., Хубер, В.В., Кунди, М., Чакраборти, А., Фуасси, Х., и Кнасмюллер, С. Предотвращение образования гетероциклических аминов -индуцированное повреждение ДНК в толстой кишке и печени крыс различными штаммами лактобацилл. Канцерогенез 2003; 24 (12): 1913-1918. Просмотреть аннотацию.
Аль Фалех К., Анабрис Дж. Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных Syst Rev.2014; (4): CD005496.Просмотреть аннотацию.
АльФалех К., Анабрис Дж., Басслер Д., Аль-Харфи Т. Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных систематических обзоров 2011 г., выпуск 3. Ст. №: CD005496. DOI: 10.1002 / 14651858.CD005496.pub3. Просмотреть аннотацию.
Аллен С.Дж., Джордан С., Стори М., Торнтон К.А., Гравенор М.Б., Гараиова И., Пламмер С.Ф., Ван Д., Морган Г. Пробиотики в профилактике экземы: рандомизированное контролируемое исследование. Arch Dis Child 2014; 99 (11): 1014-9. Просмотреть аннотацию.
Allen SJ, Wareham K, Wang D, Bradley C, Hutchings H, Harris W, Dhar A, Brown H, Foden A, Gravenor MB, Mack D. Лактобациллы и бифидобактерии в профилактике диареи, связанной с антибиотиками, и диареи Clostridium difficile у пожилых стационарных пациентов (PLACIDE): рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование. Ланцет. 2013, 12 октября; 382 (9900): 1249-57. Просмотреть аннотацию.
Аруначалам К., Гилл Х.С., Чандра РК. Повышение естественной иммунной функции за счет диетического потребления Bifidobacterium lactis (HN019).Eur J Clin Nutr 2000; 54: 263-7. Просмотреть аннотацию.
Атали-Джапе Г., Минаи Н., Натан Э. и др. Результаты для недоношенных маленьких детей по сравнению с подходящими для беременных после приема Bifidobacterium breve M-16 V. J Matern Fetal Neonatal Med. 2020; 33 (13): 2209-2215. Просмотреть аннотацию.
Бадехноуш Б., Карамали М., Заррати М. и др. Влияние пробиотических добавок на биомаркеры воспаления, окислительного стресса и исходы беременности при гестационном диабете. J Matern Fetal Neonatal Med.2018 Май; 31 (9): 1128-1136. Просмотреть аннотацию.
Бастюрк А., Артан Р., Йилмаз А. Эффективность лечения синбиотиками, пробиотиками и пребиотиками при синдроме раздраженного кишечника у детей: рандомизированное контролируемое исследование. Turk J Gastroenterol 2016; 27 (5): 439-43. Просмотреть аннотацию.
Begtrup LM, de Muckadell OB, Kjeldsen J, Christensen RD, Jarbøl DE. Длительное лечение пробиотиками у пациентов первичного звена с синдромом раздраженного кишечника — рандомизированное двойное слепое плацебо-контролируемое исследование.Сканд Дж. Гастроэнтерол 2013; 48 (10): 1127-35. Просмотреть аннотацию.
Бибилони Р., Федорак Р.Н., Таннок Г.В. и др. Пробиотическая смесь VSL # 3 вызывает ремиссию у пациентов с активным язвенным колитом. Am J Gastroenterol 2005; 100: 1539-46. Просмотреть аннотацию.
Blaabjerg S, Artzi DM, Aabenhus R. Пробиотики для профилактики антибиотико-ассоциированной диареи у амбулаторных пациентов — систематический обзор и метаанализ. Антибиотики (Базель). 2017; 6 (4). Просмотреть аннотацию.
Bouhnik Y, Pochart P, Marteau P и др.Восстановление фекалий у людей жизнеспособных бифидобактерий, попавших в ферментированное молоко. Гастроэнтерология 1992; 102: 875-8. Просмотреть аннотацию.
Батлер С.К., Лау М., Гиллеспи Д. и др. Влияние использования пробиотиков на введение антибиотиков среди жителей домов престарелых: рандомизированное клиническое исследование. ДЖАМА. 2020; 324 (1): 47-56. Просмотреть аннотацию.
Caglar E. Влияние йогурта, содержащего Bifidobacterium bifidum, на бактерии зубного налета у детей. J Clin Pediatr Dent. 2014; 38 (4): 329-32. Просмотреть аннотацию.
Callaway LK, McIntyre HD, Barrett HL и др. Пробиотики для профилактики гестационного сахарного диабета у женщин с избыточным весом и ожирением: результаты двойного слепого рандомизированного контролируемого исследования SPRING. Уход за диабетом. 2019; 42 (3): 364-371. Просмотреть аннотацию.
Chang HY, Chen JH, Chang JH, Lin HC, Lin CY, Peng CC. Пробиотики с множественными штаммами, по-видимому, являются наиболее эффективными пробиотиками в профилактике некротического энтероколита и смертности: обновленный метаанализ. PLoS One.2017; 12 (2): e0171579. Просмотреть аннотацию.
Чен Р.М., Ву Дж.Дж., Ли С.К. и др. Увеличение кишечных бифидобактерий и подавление бактерий группы кишечной палочки при кратковременном приеме йогурта. J Dairy Sci 1999: 82: 2308-14. Просмотреть аннотацию.
Chiang BL, Sheih YH, Wang LH, et al. Повышение иммунитета путем употребления с пищей пробиотических молочнокислых бактерий (Bifidobacterium lactis HN019): оптимизация и определение клеточных иммунных ответов. Eur J Clin Nutr 2000; 54: 849-55. Просмотреть аннотацию.
Colombel JF, Cortot A, Neut C, Romond C. Йогурт с Bifidobacterium longum снижает желудочно-кишечные эффекты, вызванные эритромицином. Ланцет 1987; 2: 43.
Костелое К., Харди П., Ющак Е., Уилкс М., Миллар М.Р .; Пробиотики в совместной группе по изучению недоношенных детей. Bifidobacterium breve BBG-001 у очень недоношенных детей: рандомизированное контролируемое исследование фазы 3. Ланцет. 2016 13 февраля; 387 (10019): 649-60. Просмотреть аннотацию.
Кремонини Ф, Ди Каро С., Ковино М. и др. Влияние различных пробиотических препаратов на побочные эффекты, связанные с терапией против Helicobacter pylori: параллельное групповое, тройное слепое, плацебо-контролируемое исследование.Am J Gastroenterol 2002; 97: 2744-9. Просмотреть аннотацию.
Czajeczny D, Kabzi & nacute; ska K, W & oacute; jciak RW. Помогают ли добавки с пробиотиками похудеть? Рандомизированное простое слепое плацебо-контролируемое исследование с добавлением Bifidobacterium lactis BS01 и Lactobacillus acidophilus LA02. Ешьте расстройство веса. 2020. Посмотреть аннотацию.
Дикерсон Ф., Адамос М., Кацафанас Э. и др. Дополнительные пробиотические микроорганизмы для предотвращения повторной госпитализации пациентов с острой манией: рандомизированное контролируемое исследование.Биполярное расстройство. 2018 25 апреля. Посмотреть аннотацию.
Dimidi E, Christodoulides S, Fragkos KC, Scott SM, Whelan K. Влияние пробиотиков на функциональный запор у взрослых: систематический обзор и метаанализ рандомизированных контролируемых исследований. Am J Clin Nutr. 2014; 100 (4): 1075-84. Просмотреть аннотацию.
Элмер GW, Суравич CM, МакФарланд LV. Биотерапевтические агенты, метод лечения и профилактики отдельных кишечных и вагинальных инфекций, которым пренебрегают. JAMA 1996; 275: 870-5.Просмотреть аннотацию.
Eskesen D, Jespersen L, Michelsen B, Whorwell PJ, Müller-Lissner S, Morberg CM. Действие пробиотического штамма Bifidobacterium animalis subsp. lactis, BB-12®, о частоте дефекации у здоровых субъектов с низкой частотой дефекации и дискомфортом в животе: рандомизированное двойное слепое плацебо-контролируемое исследование в параллельных группах. Br J Nutr. 2015 28 ноября; 114 (10): 1638-46. Просмотреть аннотацию.
Fernández-Carrocera LA, Solis-Herrera A, Cabanillas-Ayón M, Gallardo-Sarmiento RB, García-Pérez CS, Montaño-Rodríguez R, Echániz-Aviles MO.Двойной слепой рандомизированный клинический анализ для оценки эффективности пробиотиков у недоношенных новорожденных с массой тела менее 1500 г в профилактике некротизирующего энтероколита. Arch Dis Child Fetal Neonatal Ed 2013; 98 (1): F5-9. Просмотреть аннотацию.
Gionchetti P, Rizzello F, Venturi A, et al. Пероральная бактериотерапия в качестве поддерживающей терапии у пациентов с хроническим поучитом: двойное слепое плацебо-контролируемое исследование. Гастроэнтерология 2000; 119: 305-9. Просмотреть аннотацию.
Goldenberg JZ, Lytvyn L, Steurich J, Parkin P, Mahant S, Johnston BC.Пробиотики для профилактики детской диареи, связанной с антибиотиками. Кокрановская база данных Syst Rev.2015; (12): CD004827. Просмотреть аннотацию.
Голдин BR. Польза пробиотиков для здоровья. Br J Nutr 1998; 80: S203-7. Просмотреть аннотацию.
Гор C, Custovic A, Tannock GW, Munro K, Kerry G, Johnson K, Peterson C, Morris J, Chaloner C, Murray CS, Woodcock A. Лечебные и вторичные профилактические эффекты пробиотиков Lactobacillus paracasei или Bifidobacterium lactis на раннем этапе детская экзема: рандомизированное контролируемое исследование с периодом наблюдения до 3 лет.Clin Exp Allergy 2012; 42 (1): 112-22. Просмотреть аннотацию.
Guardamagna O, Amaretti A, Puddu PE, et al. Добавка бифидобактерий: влияние на липидный профиль плазмы у детей с дислипидемией. Питание. 2014; 30 (7-8): 831-6. Просмотреть аннотацию.
Ha GY, Yang CH, Kim H, Chong Y. Случай сепсиса, вызванного Bifidobacterium longum. J. Clin Microbiol 1999; 37: 1227-8. Просмотреть аннотацию.
Хан К., Ван Дж., Сео Дж. Г., Ким Х. Эффективность пробиотиков с двойным покрытием при синдроме раздраженного кишечника: рандомизированное двойное слепое контролируемое исследование.J Gastroenterol. 2017; 52 (4): 432-443. Просмотреть аннотацию.
Хираяма К., Рафтер Дж. Роль пробиотических бактерий в профилактике рака. Microbes Infect 2000; 2: 681-6. Просмотреть аннотацию.
Hojsak I, Tokic Pivac V, Mocic Pavic A, Pasini AM, Kolacek S. Bifidobacterium animalis subsp. lactis не может предотвратить распространенные инфекции у госпитализированных детей: рандомизированное двойное слепое плацебо-контролируемое исследование. Am J Clin Nutr. 2015 Март; 101 (3): 680-4. Просмотреть аннотацию.
Hoyos AB. Снижение частоты возникновения некротического энтероколита, связанного с энтеральным введением Lactobacillus acidophilus и Bifidobacterium infantis новорожденным в отделении интенсивной терапии.Int J Infect Dis 1999; 3: 197-202. Просмотреть аннотацию.
Ibarra A, Latreille-Barbier M, Donazzolo Y, Pelletier X, Ouwehand AC. Эффекты 28-дневного Bifidobacterium animalis subsp. lactis HN019 в отношении времени прохождения через толстую кишку и желудочно-кишечных симптомов у взрослых с функциональным запором: двойное слепое рандомизированное плацебо-контролируемое исследование с определением дозировки. Кишечные микробы. 2018; 9 (3): 236-251. Просмотреть аннотацию.
Иноуэ Т., Кобаяши Ю., Мори Н. и др. Влияние комбинированного приема бифидобактерий и тренировок с отягощениями на когнитивные функции, состав тела и привычки кишечника здоровых пожилых людей.Benef Microbes. 2018; 9 (6): 843-853. Просмотреть аннотацию.
Исикава Х., Акедо И., Умесаки Ю. и др. Рандомизированное контролируемое исследование влияния ферментированного бифидобактериями молока на язвенный колит. J Am Coll Nutr 2003; 22: 56-63. Просмотреть аннотацию.
Isolauri E, Arvola T, Sutas Y, et al. Пробиотики в лечении атопической экземы. Clin Exp Allergy 2000; 30: 1604-10. Просмотреть аннотацию.
Jäger R, Purpura M, Stone JD и др. Прием пробиотиков Streptococcus thermophilus FP4 и Bifidobacterium breve BR03 снижает работоспособность и объем движений после упражнений, повреждающих мышцы.Питательные вещества 2016; 8 (10). pii: E642. Просмотреть аннотацию.
Jayasimhan S, Yap NY, Roest Y, Rajandram R, Chin KF. Эффективность препарата микробных клеток в улучшении хронического запора: рандомизированное двойное слепое плацебо-контролируемое исследование. Clin Nutr 2013; 32 (6): 928-34. Просмотреть аннотацию.
Jiang C, Wang H, Xia C, et al. Рандомизированное двойное слепое плацебо-контролируемое исследование пробиотиков для уменьшения тяжести мукозита полости рта, вызванного химиолучевой терапией, у пациентов с карциномой носоглотки.Рак. 2019; 125 (7): 1081-1090. Просмотреть аннотацию.
Jiao X, Fu MD, Wang YY, Xue J, Zhang Y. Bifidobacterium и Lactobacillus для предотвращения некротического энтероколита у недоношенных детей с очень низкой массой тела при рождении: систематический обзор и метаанализ. Мир J Pediatr. 2020; 16 (2): 135-142. Просмотреть аннотацию.
Калима П., Мастертон Р.Г., Родди П.Х. и др. Инфекция Lactobacillus rhamnosus у ребенка после трансплантации костного мозга. J Infect 1996; 32: 165-7. Просмотреть аннотацию.
Карамали М., Дадхах Ф., Садрханлоу М. и др.Влияние пробиотических добавок на гликемический контроль и липидный профиль при гестационном диабете: рандомизированное двойное слепое плацебо-контролируемое исследование. Диабет Метаб 2016; 42 (4): 234-41. Просмотреть аннотацию.
Като К., Мизуно С., Умесаки Ю. и др. Рандомизированное плацебо-контролируемое исследование по оценке влияния ферментированного бифидобактериями молока на активный язвенный колит. Алимент Фармакол Тер 2004; 20: 1133-41. Просмотреть аннотацию.
Kim HJ, Camilleri M, McKinzie S, et al. Рандомизированное контролируемое испытание пробиотика VSL # 3 в отношении кишечного транзита и симптомов синдрома раздраженного кишечника с преобладанием диареи.Aliment Pharmacol Ther 2003; 17: 895-904. . Просмотреть аннотацию.
Кобаяши Y, Кухара Т, Оки М, Сяо Джозеф. Влияние Bifidobacterium breve A1 на когнитивные функции пожилых людей с жалобами на память: рандомизированное двойное слепое плацебо-контролируемое исследование. Benef Microbes. 2019; 10 (5): 511-520. Просмотреть аннотацию.
Корщунов В.М., Смеянов В.В., Ефимов Б.А. и др. Терапевтическое применение препарата устойчивых к антибиотикам бифидобактерий у мужчин, подвергшихся воздействию высоких доз гамма-излучения. J Med Microbiol 1996; 44: 70-4.Просмотреть аннотацию.
Кухбахер Т., Отт С.Дж., Хельвиг У. и др. Бактериальная и грибковая микробиота в связи с пробиотической терапией (VSL # 3) при поучите. Кишечник 2006; 55: 833-41. Просмотреть аннотацию.
Langkamp-Henken B, Rowe CC, Ford AL, Christman MC, Nieves C. Jr, Khouri L, Specht GJ, Girard SA, Spaiser SJ, Dahl WJ. Bifidobacterium bifidum R0071 приводит к большему количеству дней здорового образа жизни и меньшему проценту студентов, испытывающих академический стресс, сообщающих о дне простуды / гриппа: рандомизированное двойное слепое плацебо-контролируемое исследование.Br J Nutr. 2015 14; 113 (3): 426-34. Просмотреть аннотацию.
Lau AS, Yanagisawa N, Hor YY, et al. Bifidobacterium longum BB536 облегчает заболевания верхних дыхательных путей и регулирует профили кишечной микробиоты у малазийских дошкольников. Benef Microbes. 2018; 9 (1): 61-70. Просмотреть аннотацию.
Лау С.С., Чемберлен Р.С. Пробиотики эффективны для предотвращения диареи, связанной с Clostridium difficile: систематический обзор и метаанализ. Int J Gen Med. 2016; 9: 27-37. Просмотреть аннотацию.
Льюис Э.Д., Энтони Дж. М., Кроули, округ Колумбия, и др.Эффективность Lactobacillus paracasei HA-196 и Bifidobacterium longum R0175 в облегчении симптомов синдрома раздраженного кишечника (СРК): рандомизированное плацебо-контролируемое исследование. Питательные вещества. 2020; 12 (4): 1159. Просмотреть аннотацию.
Льюис С.Дж., Фридман АР. Обзорная статья: использование биотерапевтических средств в профилактике и лечении желудочно-кишечных заболеваний. Aliment Pharmacol Ther 1998; 12: 807-22. Просмотреть аннотацию.
Leyer GJ, Li S, Mubasher ME, et al. Влияние пробиотиков на частоту и продолжительность симптомов простуды и гриппа у детей.Педиатрия 2009; 124: e172-e179. Просмотреть аннотацию.
Ливин В., Пайффер И., Худо С. и др. Штаммы Bifidobacterium из резидентной микрофлоры желудочно-кишечного тракта человека грудного возраста обладают антимикробной активностью. Gut 2000; 47: 646-52. Просмотреть аннотацию.
Lin CL, Hsu YJ, Ho HH и др. Bifidobacterium longum subsp. Добавка longum OLP-01 во время тренировок по бегу на выносливость улучшает результаты упражнений у бегунов на средние и длинные дистанции: двойное слепое контролируемое испытание. Питательные вещества. 2020; 12 (7): 1972.Просмотреть аннотацию.
Linn YH, Thu KK, Win NHH. Влияние пробиотиков на предотвращение острой радиационно-индуцированной диареи среди пациентов с раком шейки матки: рандомизированное двойное слепое плацебо-контролируемое исследование. Пробиотики, антимикробные белки. 2019; 11 (2): 638-647. Просмотреть аннотацию.
Лю Дж, Хуанг XE. Эффективность таблеток жизнеспособных бактерий Bifidobacterium tetragenous для онкологических больных с функциональным запором. Азиатский Pac J Cancer Prev. 2014; 15 (23): 10241-4. Просмотреть аннотацию.
Macfarlane GT, Каммингс Дж. Х.Пробиотики и пребиотики: может ли регулирование активности кишечных бактерий принести пользу здоровью? BMJ 1999; 318: 999-1003. Просмотреть аннотацию.
Манжалий Э., Вирченко О., Фалалеева Т., Берегова Т., Стреммель В. Лечебная эффективность пробиотического препарата при неалкогольном стеатогепатите: пилотное исследование. J Dig Dis. 2017; 18 (12): 698-703. Просмотреть аннотацию.
Мацуока К., Уэмура Ю., Канаи Т. и др. Эффективность кисломолочного молока Bifidobacterium breve в поддержании ремиссии язвенного колита.Dig Dis Sci. 2018; 63 (7): 1910-1919. Просмотреть аннотацию.
McFarland LV. Мета-анализ пробиотиков для профилактики диареи, связанной с антибиотиками, и лечения болезни Clostridium difficile. Am J Gastroenterol 2006; 101: 812-22. Просмотреть аннотацию.
Мейдани С.Н., Ха В.К. Иммунологические эффекты йогурта. Am J Clin Nutr 2000; 71: 861-72. Просмотреть аннотацию.
Майкл Д.Р., Джек А.А., Мазетти Дж. И др. Рандомизированное контролируемое исследование показывает, что добавление лактобактерий и бифидобактерий взрослым с избыточным весом и ожирением снижает массу тела и улучшает самочувствие.Научный доклад 2020; 10 (1): 4183. Просмотреть аннотацию.
Miele E, Pascarella F, Giannetti E. et al. Влияние пробиотического препарата (VSL # 3) на индукцию и поддержание ремиссии у детей с язвенным колитом. Am J Gastroenterol 2009; 104: 437-43. Просмотреть аннотацию.
Мимура Т., Риццелло Ф., Хельвиг У. и др. Терапия пробиотиками в высоких дозах (VSL # 3) один раз в день для поддержания ремиссии при рецидивирующем или рефрактерном поухите. Кишечник 2004; 53: 108-14. Просмотреть аннотацию.
О’Каллаган А, ван Синдерен Д.Бифидобактерии и их роль как членов кишечной микробиоты человека. Front Microbiol. 2016 15 июня; 7: 925. Просмотреть аннотацию.
О’Махони Л., Маккарти Дж., Келли П. и др. Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и взаимосвязь с профилями цитокинов. Гастроэнтерология 2005; 128: 541-51. Просмотреть аннотацию.
Olivares M, Castillejo G, Varea V, Sanz Y. Двойное слепое рандомизированное плацебо-контролируемое исследование для оценки эффектов Bifidobacterium longum CECT 7347 у детей с впервые диагностированной целиакией.Br J Nutr. 2014 июл 14; 112 (1): 30-40. Просмотреть аннотацию.
Park MS, Kwon B, Ku S, Ji GE4. Эффективность лечения пробиотиками Bifidobacterium longum BORI и Lactobacillus acidophilus AD031 у младенцев с ротавирусной инфекцией. Питательные вещества. 2017; 9 (8). pii: E887. Просмотреть аннотацию.
Phuapradit P, Varavithya W., Vathanophas K, et al. Снижение ротавирусной инфекции у детей, получающих смесь с бифидобактериями. J Med Assoc Thai 1999; 82: S43-8. Просмотреть аннотацию.
Пирс А.Практическое руководство по натуральным лекарствам Американской фармацевтической ассоциации. Нью-Йорк: The Stonesong Press, 1999: 19.
Pinto GS, Cenci MS, Azevedo MS, Epifanio M, Jones MH. Действие йогурта, содержащего Bifidobacterium animalis subsp. lactis DN-173010 пробиотик на зубном налете и слюне у ортодонтических пациентов. Caries Res. 2014; 48 (1): 63-8. Просмотреть аннотацию.
Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Пробиотик Bifidobacterium longum NCC3001 снижает показатели депрессии и изменяет активность мозга: пилотное исследование у пациентов с синдромом раздраженного кишечника.Гастроэнтерология 2017; 153 (2): 448-459.e8. Просмотреть аннотацию.
Pruccoli G, Silvestro E, Pace Napoleone C, Aidala E, Garazzino S, Scolfaro C. Безопасны ли пробиотики? Бифидобактериальная бактериемия у ребенка с тяжелой сердечной недостаточностью. Infez Med. 2019; 27 (2): 175-178. Просмотреть аннотацию.
Расталль РА. Бактерии в кишечнике: друзья и враги и как изменить баланс. J Nutr 2004; 134: 2022S-2026S. Просмотреть аннотацию.
Rautava S, Kainonen E, Salminen S, Isolauri E. Материнский пробиотик добавление во время беременности и кормления грудью снижает риск экземы у младенца.J Allergy Clin Immunol. 2012; 130 (6): 1355-60. Просмотреть аннотацию.
Раутио М., Джусими-Сомер Х, Каума Х и др. Абсцесс печени, вызванный штаммом Lactobacillus rhamnosus, неотличимым от штамма L. rhamnosus GG. Clin Infect Dis 1999; 28: 1159-60. Просмотреть аннотацию.
Rerksuppaphol S, Rerksuppaphol L. Рандомизированное контролируемое исследование пробиотиков для лечения простуды у школьников. Pediatr Int. 2012; 54 (5): 682-7. Просмотреть аннотацию.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr 2000; 71: 1682S-7S.Просмотреть аннотацию.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr. 2000; 71 (6 доп.): 1682С-7С; обсуждение 1688С-90С. Просмотреть аннотацию.
Saavedra JM, et al. Кормление младенцев в больнице бифидобактериями бифидум и термофильным стрептококком для профилактики диареи и выделения ротавируса. Ланцет 1994; 344: 1046-9. Просмотреть аннотацию.
Zhang J, Ma S, Wu S, Guo C, Long S, Tan H. Эффекты пробиотических добавок у беременных с гестационным сахарным диабетом: систематический обзор и метаанализ рандомизированных контролируемых исследований.J Diabetes Res. 2019; 2019: 5364730. Просмотреть аннотацию.
Чжу XL, Тан XG, Цюй Ф, Чжэн Y, Чжан WH, Diao YQ. Bifidobacterium может помочь в профилактике некротического энтероколита у недоношенных детей: систематический обзор и метаанализ. Int J Surg. 2019; 61: 17-25. Просмотреть аннотацию.
Bifidobacterium — обзор | ScienceDirect Topics
Влияние олигосахаридов человеческого молока на рост
Bifidobacterium : Lacto- N -Biose HypothesisБифидобактерии составляют около 95–99.9% от общей микрофлоры толстой кишки в течение 1 недели после рождения у младенцев, находящихся на грудном вскармливании. Эта доля ниже во флоре грудных детей, находящихся на искусственном вскармливании, даже когда в заменителе молока присутствуют пребиотические олигосахариды, такие как лактулоза, галактоолигосахариды или фруктоолигосахариды. Кал 700 детей на грудном вскармливании, 232 детей на искусственном вскармливании и 98 детей, получавших сочетание грудного вскармливания и вскармливания смеси, собирали через 1 месяц после родов, а затем изучали микрофлору толстой кишки с использованием количественного анализа ПЦР в реальном времени после извлечение микробной ДНК.Как у детей, вскармливаемых грудью, так и на искусственном вскармливании преобладали бифидобактерии в микрофлоре толстой кишки, но дети, вскармливаемые смесями, чаще содержали Escherichia coli , Clostridium difficile , группу Bacteroides fragilis и группу Lactobacillus виды в микрофлоре толстой кишки, чем у их сверстников, находящихся на грудном вскармливании. Было высказано предположение, что компоненты молока стимулируют рост бифидобактерий толстой кишки. Как упоминалось выше, считается, что ОПЗ действуют как пребиотики, которые стимулируют рост бифидобактерий в нижнем отделе кишечника; это снижает pH толстой кишки, что может подавлять рост патогенных бактерий, таких как E.coli .
Какие из более чем 130 различных ОПЗ стимулируют рост бифидобактерий толстой кишки младенца? Китаока с соавторами предположили, что олигосахариды молока, содержащие LNB, являются специфическими факторами роста для некоторых видов Bifidobacterium . Эта гипотеза о лакто- N -биозе основана на опубликованной информации о геноме, относящейся к бифидобактериям и клонированию гликогидролаз, гликофосфорилазы и переносчика ABC из штамма Bifidobacterium longum .Первоначально эта гипотеза была основана на открытии фермента в клеточных экстрактах B. bifidum , который фосфоролизирует лакто- N -биозу, продукты которой представляют собой галактозо-1-фосфат и N -ацетилглюкозамин: этот фермент впоследствии был очищен, и его ген, lnp A , из B. longum был клонирован. Было обнаружено, что ген lnp A расположен в новом опероне метаболизма галактозы, который также включает гены муциндесульфатазы и Gal-1-P уридилтрансферазы и UDP-Glc-4-эпимеразы, а также ген АТФ-связывающий кассетный транспортер сахара (см. , фиг. 2, ).Кроме того, было продемонстрировано, что лакто- N -биоза фосфорилаза может также использовать галакто- N -биозу (GNB; Gal (β1-3) GalNAc), которая является основной единицей муцина, в качестве субстрата, но не N -ацетиллактозамин (LacNAc, Gal (β1-4) GlcNAc).
Высокое содержание и увеличение концентраций LNB-содержащих олигосахаридов, таких как LNT, LNFP I и LNDFH I, в молоке / молозиве на ранних стадиях может значительно повлиять на формирование бифидофлоры в толстой кишке младенца.Метаболизм LNFP I, который является доминирующей HMO, с помощью B. bifidum JCM1254 был уточнен путем клонирования α-фукозидазы, которая катализирует высвобождение невосстанавливающей фукозы из LNFP I, и лакто- N -биозидазы. , который катализирует гидролиз LNB с образованием LNB и лактозы, а также путем очистки и кристаллизации транспортера типа ABC, который доставляет LNB через клеточную мембрану. Поскольку лакто- N -биозофосфорилаза была очищена из экстракта этого штамма бифидобактерий, было высказано предположение, что его α-фукозидаза продуцирует LNT из LNFP I, в то время как его лакто- N -биозидаза высвобождает LNB из LNT, что является с последующим захватом LNB через клеточную мембрану; LNB затем метаболизируется до галактозо-1-фосфата и N -ацетилглюкозамина, как показано на фиг. , фиг. 2, .Можно с уверенностью ожидать, что форма симбиоза между таким штаммом B. bifidum и другим штаммом бифидобактерий, который имеет переносчик типа ABC и лакто- N -биоз-фосфорилазу, но не имеет α-фукозидазы и лактофосфорилазы. — N -биозидаза, может быть продемонстрирована. Возможный метаболический путь для N -ацетилглюкозамина, продуцируемого из LNFP I или LNT (см. Выше), предлагается на основе анализа генных продуктов оперона галактозы B.longum ssp. longum NCC2705; N -ацетилглюкозамин превращается в N -ацетилглюкозамин-1-фосфат новым ферментом N -ацетилгексозамин-1-киназой и затем в UDP- N -ацетилглюкозамин, наконец, UDP-глюкозо-гексозеридилтрансфат-1-фосфат вступая в метаболический путь аминосахаров. На основании этих результатов можно частично объяснить стимулирующий рост эффект ОПЗ на некоторые штаммы бифидобактерий, такие как B. bifidum .
Рисунок 2. Лакто- N -биозная гипотеза. BL, Bifidobacterium longum ; GL-BP, галакто- N -биоза / лакто- N -биоза I-связывающий белок; GLNBP, галакто- N -биоза / лакто- N -биоза I фосфорилаза.
Как уже упоминалось, доминирующими олигосахаридами грудного молока / молозива являются 2′-FL, LNFP I, LNDFH I и LNT, последние три из которых являются олигосахаридами типа I, которые содержат элемент LNB; они составляют 25–30% от общего количества олигосахаридов молока.Однако молоко или молозиво почти всех млекопитающих, кроме человека, содержит только олигосахариды типа II, которые содержат N -ацетиллактозамин (Gal (β1-4) GlcNAc). Недавно были изучены молочные олигосахариды видов, которые тесно связаны с людьми, а именно человекообразных обезьян (шимпанзе, бонобо, горилла и орангутан) и более мелких обезьян (сиаманг). Было обнаружено, что молоко горилл и сиаманг, как и молоко других млекопитающих, кроме человека, содержит только олигосахариды типа II, тогда как молоко или молозиво шимпанзе, бонобо и орангутана содержат как тип I, так и тип II, но олигосахариды типа II преобладают над типом I.Эти результаты показывают, что преобладание олигосахаридов типа I в молоке / молозиве является особенностью, специфичной для людей, и предполагают, что приобретение этого преобладания могло иметь селективное преимущество для людей по сравнению с бифидофлорой у их младенцев.
Польза для здоровья, побочные эффекты, применение, дозы и меры предосторожности
Abe, F., Muto, M., Yaeshima, T., Iwatsuki, K., Aihara, H., Ohashi, Y., and Fujisawa, T. Оценка безопасности пробиотических бифидобактерий путем анализа активности разложения муцина и способности к транслокации .Анаэроб. 2010; 16 (2): 131-136. Просмотреть аннотацию.
Акацу, Х., Ивабути, Н., Сяо, Дж. З., Мацуяма, З., Курихара, Р., Окуда, К., Ямамото, Т., и Маруяма, М. Клинические эффекты пробиотических бактерий Bifidobacterium longum BB536 на иммунную систему. Функция и кишечная микробиота у пожилых пациентов, получающих энтеральное зондовое питание. JPEN J Parenter Enteral Nutr 11-27-2012; Просмотреть аннотацию.
Андраде, С. и Борхес, Н. Влияние ферментированного молока, содержащего Lactobacillus acidophilus и Bifidobacterium longum, на липиды плазмы женщин с нормальным или умеренно повышенным холестерином.J.Dairy Res. 2009; 76 (4): 469-474. Просмотреть аннотацию.
Арая-Кодзима Томоко, Яэшима Томоко Исибаши Норио Симамура Сейичи Хаясава Хиротоши. Ингибирующее действие Bifidobacterium longum BB536 на вредные кишечные бактерии. Бифидобактерии Microflora 1995; 14 (2): 59-66.
Баллонг Дж., Гриль Дж. Барат-Евлог П. Действие по цвету кишечных ферментов с бифидобактериями. Lait 1993; 73: 249-256.
Беннет Р., Норд К. Э. и Зеттерстром Р. Временная колонизация кишечника новорожденных младенцев перорально вводимыми бифидобактериями и лактобактериями.Acta Paediatr. 1992; 81 (10): 784-787. Просмотреть аннотацию.
Берцик П., Парк, А.Дж., Синклер, Д., Хошдел, А., Лу, Дж., Хуанг, X., Дэн, Ю., Бленнерхассет, Пенсильвания, Фанесток, М., Мойн, Д., Бергер, Б., Хейзинга, Дж. Д., Кунце, В., Маклин, П. Г., Бергонзелли, Г. Е., Коллинз, С. М. и Верду, Е. Ф. Анксиолитический эффект Bifidobacterium longum NCC3001 включает вагусные пути для связи кишечника с мозгом. Нейрогастроэнтерол.Мотил. 2011; 23 (12): 1132-1139. Просмотреть аннотацию.
Чалла, А., Rao, D. R., Chawan, C. B. и Shackelford, L. Bifidobacterium longum и лактулоза подавляют индуцированные азоксиметаном аберрантные очаги крипт толстой кишки у крыс. Канцерогенез 1997; 18 (3): 517-521. Просмотреть аннотацию.
Chouraqui, JP, Grathwohl, D., Labaune, JM, Hascoet, JM, de, Montgolfier, I, Leclaire, M., Giarre, M., and Steenhout, P. Оценка безопасности, переносимости и защитного эффекта против диареи смесей для младенцев, содержащих смеси пробиотиков или пробиотиков и пребиотиков, в рандомизированном контролируемом исследовании.Am.J Clin.Nutr. 2008; 87 (5): 1365-1373. Просмотреть аннотацию.
Crociani, J., Grill, J. P., Huppert, M. и Ballongue, J. Адгезия различных штаммов бифидобактерий к человеческим энтероцитоподобным клеткам Caco-2 и сравнение с исследованием in vivo. Lett.Appl.Microbiol. 1995; 21 (3): 146-148. Просмотреть аннотацию.
Дас Р.Р. Сингх М., Шафик Н. Пробиотики в лечении аллергического ринита. Журнал Всемирной организации аллергии 2010; 3 (9): 239-244.
del Giudice, M. M. и Brunese, F. P. Пробиотики, пребиотики и аллергия у детей: что нового за последний год? J Clin.Гастроэнтерол. 2008; 42 Приложение 3, часть 2: S205-S208. Просмотреть аннотацию.
Фирмансьях, А., Двапурванторо, П.Г., Кадим, М., Алатас, С., Конус, Н., Лестарина, Л., Буиссе, Ф. и Стинхаут, П. Улучшение роста малышей, которых кормили молоком, содержащим синбиотики . Азия Pac.J Clin.Nutr. 2011; 20 (1): 69-76. Просмотреть аннотацию.
Джанотти, Л., Морелли, Л., Гальбиати, Ф., Роккетти, С., Коппола, С., Бенедуче, А., Джилардини, К., Зоненсчейн, Д., Несполи, А., и Брага, M. Рандомизированное двойное слепое исследование периоперационного введения пробиотиков пациентам с колоректальным раком.Мир Дж. Гастроэнтерол. 1-14-2010; 16 (2): 167-175. Просмотреть аннотацию.
Гриль, Дж. П., Мангино-Дурр, К., Шнайдер, Ф. и Баллонге, Дж. Бифидобактерии и пробиотические эффекты: действие видов Bifidobacterium на конъюгированные соли желчных кислот. Curr.Microbiol. 1995; 31 (1): 23-27. Просмотреть аннотацию.
Grzeskowiak, L., Gronlund, MM, Beckmann, C., Salminen, S., von, Berg A. и Isolauri, E. Влияние перинатального пробиотического вмешательства на микробиоту кишечника: двойные слепые плацебо-контролируемые испытания в Финляндия и Германия.Анаэроб. 2012; 18 (1): 7-13. Просмотреть аннотацию.
Хаскоет, Дж. М., Хьюберт, К., Рошат, Ф., Леганер, Х., Гага, С., Эмади-Азар, С., и Стинхаут, П. Г. Влияние состава смеси на развитие микробиоты кишечника младенцев. J Педиатр, гастроэнтерол, питание. 2011; 52 (6): 756-762. Просмотреть аннотацию.
Игараси М., Иияма И Като Р. Томита М. Асами Н. Эзава И. Влияние Bifidobacterium longum и лактулозы на прочность кости в моделях остеопороза после овариэктомии. Бифид 1994; 7: 139-147.
Ишизеки, С. Сугита М. Таката М. и Яешима Т. Изучение эффектов введения бифидобактерий на микрофлору кишечника у младенцев с низкой массой тела при рождении: эффекты введения трех видов бифидобактерий. Журнал Японского педиатрического общества 2004; 108: 283.
Ивабучи Н., Хирута Н. Канетада С. Яешима Т. Ивацуки К. Ясуи Х. Эффекты интраназального введения Bifidobacterium longum BB536 на иммунную систему слизистой оболочки дыхательных путей и вирусную инфекцию гриппа у мышей.Наука о молоке 2009; 38 (3): 129-133.
Ивабучи, Н., Такахаши, Н., Сяо, Дж. З., Мияджи, К. и Ивацуки, К. In vitro Th2-независимые цитокин-независимые Th3 подавляющие эффекты бифидобактерий. Microbiol.Immunol. 2007; 51 (7): 649-660. Просмотреть аннотацию.
Ивабути, Н., Такахаши, Н., Сяо, Дж. З., Йонедзава, С., Яэшима, Т., Ивацуки, К., и Хачимура, С. Подавляющее действие Bifidobacterium longum на производство Th3-привлекающих хемокинов индуцировало с взаимодействиями Т-лимфоцитов с антиген-презентирующими клетками.FEMS Immunol.Med.Microbiol. 2009; 55 (3): 324-334. Просмотреть аннотацию.
Iwabuchi, N., Xiao, J. Z., Yaeshima, T., and Iwatsuki, K. Пероральное введение Bifidobacterium longum уменьшает инфекцию вируса гриппа у мышей. Биол.Фарм.Булл. 2011; 34 (8): 1352-1355. Просмотреть аннотацию.
Кабейр Б. М., Язид А. М., Стефани В., Хаким М. Н., Анас О. М. и Шухайми М. Оценка безопасности Bifidobacterium pseudocatenulatum G4 по оценке на мышах BALB / c. Lett.Appl.Microbiol. 2008; 46 (1): 32-37.Просмотреть аннотацию.
Кагеяма Т., Накано и Томода Т. Сравнительное исследование перорального приема некоторых препаратов бифидобактерий. Медицина и биология (Япония) 1987; 115 (2): 65-68.
Кагеяма Т., Томода Т. Накано Ю. Эффект введения бифидобактерий у пациентов с лейкемией. Бифидобактерии Microflora. 1984; 3 (1): 29-33.
Кондо, Дж., Сяо, Дж. З., Сирахата, А., Баба, М., Абэ, А., Огава, К., и Симода, Т. Модулирующие эффекты Bifidobacterium longum BB536 на дефекацию у пожилых пациентов, получающих энтеральное питание .Всемирный журнал J Gastroenterol 4-14-2013; 19 (14): 2162-2170. Просмотреть аннотацию.
Кулькарни Н. и Редди Б. С. Ингибирующее действие культур Bifidobacterium longum на индуцированное азоксиметаном образование аберрантных очагов крипт и фекальную бактериальную бета-глюкуронидазу. Proc.Soc Exp.Biol.Med 1994; 207 (3): 278-283. Просмотреть аннотацию.
Mah, KW, Chin, VI, Wong, WS, Lay, C., Tannock, GW, Shek, LP, Aw, MM, Chua, KY, Wong, HB, Panchalingham, A., and Lee, B.W. Влияние молочная смесь, содержащая пробиотики для фекальной микробиоты азиатских младенцев с риском атопических заболеваний.Педиатр. 2007; 62 (6): 674-679. Просмотреть аннотацию.
Макрас, Л. Де Вуйст Л. Ингибирование бифидобактериями грамотрицательных патогенных бактерий in vitro вызвано производством органических кислот. Международный молочный журнал 2006; 16: 1049-1057.
Мацумото, Т., Исикава, Х., Татеда, К., Яэшима, Т., Ишибаши, Н. и Ямагути, К. Пероральное введение Bifidobacterium longum предотвращает кишечный сепсис Pseudomonas aeruginosa у мышей. J Appl.Microbiol. 2008; 104 (3): 672-680.Просмотреть аннотацию.
Momose H, Igarashi M Era T Fukuda Y Yamada M и Ogasa K. Токсикологические исследования Bifidobacterium longum BB536. Ойо якури 1979; 17 (5): 881-887.
Намба К., Яешима Т. Ишибаши Н. Хаясава Х и Ямадзаки Сёдзи. Подавляющее действие Bifidobacterium longum на энтерогеморрагическую Escherichia coli O157: H7. Биологическая микрофлора 2003; 22 (3): 85-91.
Намба К., Хатано М., Яешима Т., Такасе М. и Сузуки К. Влияние введения Bifidobacterium longum BB536 на инфекцию гриппа, титр антител к вакцине против гриппа и клеточный иммунитет у пожилых людей .Biosci.Biotechnol.Biochem. 2010; 74 (5): 939-945. Просмотреть аннотацию.
Одамаки, Т., Сугахара, Х., Ёнэдзава, С., Яешима, Т., Ивацуки, К., Танабэ, С., Томинага, Т., Тогаши, Х., Бенно, Ю., и Сяо, JZ Влияние перорального приема йогурта, содержащего Bifidobacterium longum BB536, на количество клеток энтеротоксигенных Bacteroides fragilis в микробиоте. Анаэроб. 2012; 18 (1): 14-18. Просмотреть аннотацию.
Одамаки, Т., Сяо, Дж. З., Ивабучи, Н., Сакамото, М., Такахаши, Н., Кондо, С., Ивацуки, К., Кокубо, С., Тогаши, Х., Эномото, Т., и Бенно, Ю. Колебания фекальной микробиоты у людей с поллинозом японского кедра во время сезона пыльцы и влияние приема пробиотиков. J Investig.Allergol.Clin.Immunol. 2007; 17 (2): 92-100. Просмотреть аннотацию.
Odamaki, T., Xiao, JZ, Iwabuchi, N., Sakamoto, M., Takahashi, N., Kondo, S., Miyaji, K., Iwatsuki, K., Togashi, H., Enomoto, T. , и Бенно, Ю. Влияние потребления Bifidobacterium longum BB536 на фекальную микробиоту у людей с поллинозом японского кедра в сезон пыльцы.J Med.Microbiol. 2007; 56 (Pt 10): 1301-1308. Просмотреть аннотацию.
Одамаки, Т., Сяо, Д.З., Сакамото, М., Кондо, С., Яешима, Т., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Распространение различных видов группы Bacteroides fragilis у лиц с поллинозом японского кедра. Appl.Environ.Microbiol. 2008; 74 (21): 6814-6817. Просмотреть аннотацию.
Огата Т., Кингаку М. Яэшима Т. Терагути С. Фукуватари и Ишибаши Н. Хаясава Х. Фудзисава Т. Лино Х. Влияние приема йогурта Bifidobacterium longum BB536 на кишечную среду здоровых взрослых.Microb Ecol Health Dis 1999; 11: 41-46.
Огата Т., Накамура Т. Анджитсу К. Яешима Т. Такахаши С. Фукуватари Й Ишибаши Н. Хаясава Х. Фудзисава Т. Иино Х. Влияние введения Bifidobacterium longum BB536 на кишечную среду, частоту дефекации и фекальные характеристики добровольцев-людей. Biosci Microflora 1997; 16: 53-58.
Орраге, К., Шостедт, С., и Норд, С. E. Влияние добавок с молочнокислыми бактериями и олигофруктозой на микрофлору кишечника при введении цефподоксима проксетила.J Antimicrob.Chemother. 2000; 46 (4): 603-612. Просмотреть аннотацию.
Пуччио, Г., Кахоццо, К., Мели, Ф., Рошат, Ф., Гратволь, Д., и Стинхаут, П. Клиническая оценка новой закваски для младенцев, содержащей живые Bifidobacterium longum BL999 и пребиотики. Питание 2007; 23 (1): 1-8. Просмотреть аннотацию.
Редди Б. С. и Ривенсон А. Ингибирующее действие Bifidobacterium longum на канцерогенез толстой кишки, молочной железы и печени, индуцированный 2-амино-3-метилимидазо [4,5-f] хинолином, пищевым мутагеном.Cancer Res. 9-1-1993; 53 (17): 3914-3918. Просмотреть аннотацию.
Rouge, C., Piloquet, H., Butel, MJ, Berger, B., Rochat, F., Ferraris, L., Des, Robert C., Legrand, A., de la Cochetiere, MF, N ‘ Guyen, JM, Vodovar, M., Voyer, M., Darmaun, D., and Roze, JC Пероральные добавки с пробиотиками для недоношенных новорожденных с очень низкой массой тела при рождении: рандомизированное двойное слепое плацебо-контролируемое исследование. Am.J Clin.Nutr. 2009; 89 (6): 1828-1835. Просмотреть аннотацию.
Секи М, Игараси Т Фукуда И Симамура С Касвашима Т Огаса К.Влияние кисломолочного продукта Bifidobacterium на «регулярность» среди пожилых людей. Nutr Foodstuff 1978; 31: 379-387.
Sekine I, Yoshiwara S Homma N Takanori H Tonosuka S. Влияние молока, содержащего бифидобактерии, на хемилюминесцентную реакцию периферических лейкоцитов и средний корпускулярный объем эритроцитов — возможная роль Bifidobacterium в активации макрофагов. Therapeutics (Япония) 1985; 14: 691-695.
Секин К., Кавашима Т. и Хашимото Ю. Сравнение уровней TNF-a, индуцированных Bifidobacterium longum, полученными от человека, и Bifidobacterium animalis, полученными от крысы, в перитонеальных клетках мышей.Бифидобактерии Microflora 1994; 13 (2): 79-89.
Simakachorn, N., Bibiloni, R., Yimyaem, P., Tongpenyai, Y., Varavithaya, W., Grathwohl, D., Reuteler, G., Maire, JC, Blum, S., Steenhout, P. , Benyacoub, J., и Schiffrin, EJ. Толерантность, безопасность и влияние на фекальную микробиоту энтеральной смеси, дополненной пре- и пробиотиками, у детей в критическом состоянии. J Педиатр, гастроэнтерол, питание. 2011; 53 (2): 174-181. Просмотреть аннотацию.
Сингх, Дж., Ривенсон, А., Томита, М., Шимамура, С., Ishibashi, N., and Reddy, B. S. Bifidobacterium longum, кишечная бактерия, продуцирующая молочную кислоту, ингибирует рак толстой кишки и модулирует промежуточные биомаркеры канцерогенеза толстой кишки. Канцерогенез 1997; 18 (4): 833-841. Просмотреть аннотацию.
Soh, SE, Aw, M., Gerez, I., Chong, YS, Rauff, M., Ng, YP, Wong, HB, Pai, N., Lee, BW, and Shek, LP Пробиотические добавки в первые 6 месяцев жизни у азиатских младенцев из группы риска — влияние на экзему и атопическую сенсибилизацию в возрасте 1 года.Клинический опыт аллергии 2009; 39 (4): 571-578. Просмотреть аннотацию.
Тахри К., Кроциани Дж., Баллонге Дж. И Шнайдер Ф. Воздействие трех штаммов бифидобактерий на холестерин. Lett.Appl.Microbiol. 1995; 21 (3): 149-151. Просмотреть аннотацию.
Takahashi, N., Kitazawa, H., Iwabuchi, N., Xiao, J. Z., Miyaji, K., Iwatsuki, K., and Saito, T. Иммуностимулирующий олигодезоксинуклеотид из Bifidobacterium longum подавляет иммунные ответы Th3 на мышиной модели. Clin.Exp.Immunol. 2006; 145 (1): 130-138.Просмотреть аннотацию.
Takahashi, N., Kitazawa, H., Iwabuchi, N., Xiao, JZ, Miyaji, K., Iwatsuki, K., and Saito, T. Пероральное введение иммуностимулирующей последовательности ДНК из Bifidobacterium longum улучшает Th2 / Th3 баланс в мышиной модели. Biosci.Biotechnol.Biochem. 2006; 70 (8): 2013-2017. Просмотреть аннотацию.
Takahashi, N., Kitazawa, H., Shimosato, T., Iwabuchi, N., Xiao, JZ, Iwatsuki, K., Kokubo, S., and Saito, T. Иммуностимулирующая последовательность ДНК из пробиотического штамма Bifidobacterium longum подавляет выработку IgE in vitro.FEMS Immunol.Med.Microbiol. 2006; 46 (3): 461-469. Просмотреть аннотацию.
Takeda, Y., Nakase, H., Namba, K., Inoue, S., Ueno, S., Uza, N., and Chiba, T. Улучшается регуляция T-bet и молекул плотных контактов с помощью Bifidobactrium longum. воспаление толстой кишки при язвенном колите. Воспаление. 2009; 15 (11): 1617-1618. Просмотреть аннотацию.
Тан, М. Л., Лахтинен, С. Дж., И Бойл, Р. Дж. Пробиотики и пребиотики: клинические эффекты при аллергических заболеваниях. Curr.Opin.Pediatr. 2010; 22 (5): 626-634.Просмотреть аннотацию.
Томода Т., Накано Ю. Кагеяма Т. Разрастание кишечных Candida и кандидозная инфекция у пациентов с лейкемией: эффект от введения бифидобактерий. Бифидобактерии Microflora 1988; 7 (2): 71-74.
Томода Т., Накано Ю. Кагеяма Т. Изменения в небольших группах постоянной кишечной флоры во время приема противоопухолевых или иммунодепрессивных препаратов. Медицина и биология (Япония) 1981; 103 (1): 45-49.
Томода, Т. Накано Ю. и Кагеяма Т. Вариация и прилипание видов бифидобактерий в кишечнике при пероральном введении бифидобактерий.Медицина и биология (Япония) 1986; 113 (2): 125-128.
Сяо Дж., Кондол С. Одамаки Т. Мияджи К. Яешима Т. Ивацуки К. Тогаши Х Бенно Ю. Влияние йогурта, содержащего Bifidobacterium longum BB 536, на частоту дефекации и фекальные характеристики здоровых взрослых: двойное слепое перекрестное исследование. Японский журнал молочнокислых бактерий 2007; 18 (1): 31-36.
Xiao, JZ, Kondo, S., Takahashi, N., Odamaki, T., Iwabuchi, N., Miyaji, K., Iwatsuki, K., and Enomoto, T. Изменения уровней TARC в плазме во время пыльцы японского кедра сезон и связь с развитием симптомов.Int.Arch.Allergy Immunol. 2007; 144 (2): 123-127. Просмотреть аннотацию.
Xiao, JZ, Kondo, S., Yanagisawa, N., Miyaji, K., Enomoto, K., Sakoda, T., Iwatsuki, K., and Enomoto, T. Клиническая эффективность пробиотика Bifidobacterium longum для лечения симптомов аллергии на пыльцу японского кедра у субъектов, оцениваемых в отделении воздействия окружающей среды. Аллергол. 2007; 56 (1): 67-75. Просмотреть аннотацию.
Сяо, Дж. З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Ивацуки, К., Кокубо, С., Тогаши, Х., Эномото, К., и Эномото, Т. Эффект пробиотика Bifidobacterium longum BB536 [исправленный] в облегчении клинических симптомов и модуляции уровней цитокинов в плазме при поллинозе японского кедра во время сезона пыльцы. Рандомизированное двойное слепое плацебо-контролируемое исследование. J Investig.Allergol.Clin.Immunol. 2006; 16 (2): 86-93. Просмотреть аннотацию.
Сяо, Дж. З., Кондо, С., Янагисава, Н., Такахаши, Н., Одамаки, Т., Ивабути, Н., Миядзи, К., Ивацуки, К., Тогаши, Х., Эномото, К., и Эномото, Т. Пробиотики в лечении поллиноза японского кедра: двойное слепое плацебо-контролируемое исследование. Клинический опыт аллергии 2006; 36 (11): 1425-1435. Просмотреть аннотацию.
Яешима Т., Такахаши С. Мацумото Н. Исибаши Н. Хаясава Х. Лино Х. Влияние йогурта, содержащего Bifidobacterium longum BB536, на кишечную среду, фекальные характеристики и частоту дефекации: сравнение со стандартным йогуртом. Biosci Microflora 1997; 16: 73-77.
Yaeshima T, Takahashi S Ogura A Konno T Iwatsuki K Ishibashi N Hayasawa H.Влияние неферментированного молока, содержащего Bifidobacterium longum BB536, на частоту дефекации и характеристики кала у здоровых взрослых. Журнал Nutrition Food 2001; 4 (2): 1-6.
Яешима Т., Такахаси С Ота С. Накагава К. Ишибаши Н Хирамацу А Охаши Т. Хаясава Х Иино Х. Влияние сладкого йогурта, содержащего Bifidobacterium longum BB536, на частоту дефекации и фекальные характеристики здоровых взрослых людей: сравнение со сладким стандартным йогуртом. Kenko Eiyo Shokuhin Kenkyu 1998; 1 (3/4): 29-34.
Ямазаки, С., Мачии, К., Цуюки, С., Момосе, Х., Кавашима, Т. и Уэда, К. Иммунологические реакции на моноассоциированные Bifidobacterium longum и их связь с предотвращением бактериальной инвазии. Иммунология 1985; 56 (1): 43-50. Просмотреть аннотацию.
Yap GC, Mah KW Lay C Shek LPC Aw M Chua KY Tannock GW Lee BW. Выявление фекальных Bifidobacterium infantis на первом году жизни у младенцев с риском атопии, получавших Lactobacillus rhamnosus GG и Bifidobacterium longum от рождения до 6 месяцев.Журнал Всемирной организации аллергии. 2007; WAC 2007 Abstracts S130.
Зивковиц, М., Фекаду, К., Зонтаг, Г., Набингер, У., Хубер, У.В., Кунди, М., Чакраборти, А., Фуасси, Х., и Кнасмюллер, С. Предотвращение образования гетероциклических аминов -индуцированное повреждение ДНК в толстой кишке и печени крыс различными штаммами лактобацилл. Канцерогенез 2003; 24 (12): 1913-1918. Просмотреть аннотацию.
АльФалех К., Анабрис Дж., Басслер Д., Аль-Харфи Т. Пробиотики для профилактики некротического энтероколита у недоношенных детей.Кокрановская база данных систематических обзоров 2011 г., выпуск 3. Ст. №: CD005496. DOI: 10.1002 / 14651858.CD005496.pub3. Просмотреть аннотацию.
Аруначалам К., Гилл Х.С., Чандра РК. Повышение естественной иммунной функции за счет диетического потребления Bifidobacterium lactis (HN019). Eur J Clin Nutr 2000; 54: 263-7. Просмотреть аннотацию.
Бибилони Р., Федорак Р.Н., Таннок Г.В. и др. Пробиотическая смесь VSL # 3 вызывает ремиссию у пациентов с активным язвенным колитом. Am J Gastroenterol 2005; 100: 1539-46. Просмотреть аннотацию.
Bouhnik Y, Pochart P, Marteau P, et al. Восстановление фекалий у людей жизнеспособных бифидобактерий, попавших в ферментированное молоко. Гастроэнтерология 1992; 102: 875-8. Просмотреть аннотацию.
Чен Р.М., Ву Дж.Дж., Ли С.К. и др. Увеличение кишечных бифидобактерий и подавление бактерий группы кишечной палочки при кратковременном приеме йогурта. J Dairy Sci 1999: 82: 2308-14. Просмотреть аннотацию.
Chiang BL, Sheih YH, Wang LH, et al. Повышение иммунитета путем употребления с пищей пробиотических молочнокислых бактерий (Bifidobacterium lactis HN019): оптимизация и определение клеточных иммунных ответов.Eur J Clin Nutr 2000; 54: 849-55. Просмотреть аннотацию.
Colombel JF, Cortot A, Neut C, Romond C. Йогурт с Bifidobacterium longum снижает желудочно-кишечные эффекты, вызванные эритромицином. Ланцет 1987; 2: 43.
Кремонини Ф., Ди Каро С., Ковино М. и др. Влияние различных пробиотических препаратов на побочные эффекты, связанные с терапией против Helicobacter pylori: параллельное групповое, тройное слепое, плацебо-контролируемое исследование. Am J Gastroenterol 2002; 97: 2744-9. Просмотреть аннотацию.
Элмер GW, Суравич CM, МакФарланд LV.Биотерапевтические агенты, метод лечения и профилактики отдельных кишечных и вагинальных инфекций, которым пренебрегают. JAMA 1996; 275: 870-5. Просмотреть аннотацию.
Gionchetti P, Rizzello F, Venturi A, et al. Пероральная бактериотерапия в качестве поддерживающей терапии у пациентов с хроническим поучитом: двойное слепое плацебо-контролируемое исследование. Гастроэнтерология 2000; 119: 305-9. Просмотреть аннотацию.
Голдин BR. Польза пробиотиков для здоровья. Br J Nutr 1998; 80: S203-7. Просмотреть аннотацию.
Ha GY, Yang CH, Kim H, Chong Y.Случай сепсиса, вызванного Bifidobacterium longum. J. Clin Microbiol 1999; 37: 1227-8. Просмотреть аннотацию.
Хираяма К., Рафтер Дж. Роль пробиотических бактерий в профилактике рака. Microbes Infect 2000; 2: 681-6. Просмотреть аннотацию.
Hoyos AB. Снижение частоты возникновения некротического энтероколита, связанного с энтеральным введением Lactobacillus acidophilus и Bifidobacterium infantis новорожденным в отделении интенсивной терапии. Int J Infect Dis 1999; 3: 197-202. Просмотреть аннотацию.
Исикава Х., Акедо И., Умесаки Ю. и др.Рандомизированное контролируемое исследование влияния ферментированного бифидобактериями молока на язвенный колит. J Am Coll Nutr 2003; 22: 56-63. Просмотреть аннотацию.
Isolauri E, Arvola T, Sutas Y, et al. Пробиотики в лечении атопической экземы. Clin Exp Allergy 2000; 30: 1604-10. Просмотреть аннотацию.
Калима П., Мастертон Р.Г., Родди П.Х. и др. Инфекция Lactobacillus rhamnosus у ребенка после трансплантации костного мозга. J Infect 1996; 32: 165-7. Просмотреть аннотацию.
Като К., Мизуно С., Умесаки Ю. и др.Рандомизированное плацебо-контролируемое исследование по оценке влияния ферментированного бифидобактериями молока на активный язвенный колит. Алимент Фармакол Тер 2004; 20: 1133-41. Просмотреть аннотацию.
Kim HJ, Camilleri M, McKinzie S, et al. Рандомизированное контролируемое испытание пробиотика VSL # 3 в отношении кишечного транзита и симптомов синдрома раздраженного кишечника с преобладанием диареи. Aliment Pharmacol Ther 2003; 17: 895-904. . Просмотреть аннотацию.
Корщунов В.М., Смеянов В.В., Ефимов Б.А. и др. Терапевтическое применение препарата устойчивых к антибиотикам бифидобактерий у мужчин, подвергшихся воздействию высоких доз гамма-излучения.J Med Microbiol 1996; 44: 70-4. Просмотреть аннотацию.
Кухбахер Т., Отт С.Дж., Хельвиг У. и др. Бактериальная и грибковая микробиота в связи с пробиотической терапией (VSL # 3) при поучите. Кишечник 2006; 55: 833-41. Просмотреть аннотацию.
Льюис С.Дж., Фридман АР. Обзорная статья: использование биотерапевтических средств в профилактике и лечении желудочно-кишечных заболеваний. Aliment Pharmacol Ther 1998; 12: 807-22. Просмотреть аннотацию.
Leyer GJ, Li S, Mubasher ME, et al. Влияние пробиотиков на частоту и продолжительность симптомов простуды и гриппа у детей.Педиатрия 2009; 124: e172-e179. Просмотреть аннотацию.
Ливин В., Пайффер И., Худо С. и др. Штаммы Bifidobacterium из резидентной микрофлоры желудочно-кишечного тракта человека грудного возраста обладают антимикробной активностью. Gut 2000; 47: 646-52. Просмотреть аннотацию.
Macfarlane GT, Каммингс Дж. Х. Пробиотики и пребиотики: может ли регулирование активности кишечных бактерий принести пользу здоровью? BMJ 1999; 318: 999-1003. Просмотреть аннотацию.
McFarland LV. Мета-анализ пробиотиков для профилактики диареи, связанной с антибиотиками, и лечения болезни Clostridium difficile.Am J Gastroenterol 2006; 101: 812-22. Просмотреть аннотацию.
Мейдани С.Н., Ха В.К. Иммунологические эффекты йогурта. Am J Clin Nutr 2000; 71: 861-72. Просмотреть аннотацию.
Miele E, Pascarella F, Giannetti E. et al. Влияние пробиотического препарата (VSL # 3) на индукцию и поддержание ремиссии у детей с язвенным колитом. Am J Gastroenterol 2009; 104: 437-43. Просмотреть аннотацию.
Мимура Т., Риццелло Ф., Хельвиг У. и др. Терапия пробиотиками в высоких дозах (VSL # 3) один раз в день для поддержания ремиссии при рецидивирующем или рефрактерном поухите.Кишечник 2004; 53: 108-14. Просмотреть аннотацию.
О’Махони Л., Маккарти Дж., Келли П. и др. Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и взаимосвязь с профилями цитокинов. Гастроэнтерология 2005; 128: 541-51. Просмотреть аннотацию.
Phuapradit P, Varavithya W., Vathanophas K, et al. Снижение ротавирусной инфекции у детей, получающих смесь с бифидобактериями. J Med Assoc Thai 1999; 82: S43-S48. Просмотреть аннотацию.
Пирс А. Практическое руководство по натуральным лекарствам Американской фармацевтической ассоциации.Нью-Йорк: The Stonesong Press, 1999: 19.
Расталл РА. Бактерии в кишечнике: друзья и враги и как изменить баланс. J Nutr 2004; 134: 2022S-2026S. Просмотреть аннотацию.
Раутио М., Джусими-Сомер Х, Каума Х и др. Абсцесс печени, вызванный штаммом Lactobacillus rhamnosus, неотличимым от штамма L. rhamnosus GG. Clin Infect Dis 1999; 28: 1159-60. Просмотреть аннотацию.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr 2000; 71: 1682S-7S.Просмотреть аннотацию.
Saavedra JM, et al. Кормление младенцев в больнице бифидобактериями бифидум и термофильным стрептококком для профилактики диареи и выделения ротавируса. Ланцет 1994; 344: 1046-9. Просмотреть аннотацию.
Сайранен, У., Пиирайнен, Л., Грастен, С., Томпури, Т., Матто, Дж., Саарела, М., и Корпела, Р. Влияние пробиотиков ферментированного молока и инулина на функции и микроэкологию кишечника. J Dairy Res 2007; 74 (3): 367-373. Просмотреть аннотацию.
Saxelin M, Chuang NH, Chassy B и др.Лактобациллы и бактериемия на юге Финляндии 1989-1992 гг. Clin Infect Dis 1996; 22: 564-6. Просмотреть аннотацию.
Scarpignato C, Rampal P. Профилактика и лечение диареи путешественников: клинический фармакологический подход. Химиотерапия 1995; 41: 48-81. Просмотреть аннотацию.
Салливан А, Баркхольт Л, Север СЕ. Lactobacillus acidophilus, Bifidobacterium lactis и Lactobacillus F19 предотвращают связанные с антибиотиками экологические нарушения Bacteroides fragilis в кишечнике. Журнал Antimicrob Chemother 2003; 52: 308-11.Просмотреть аннотацию.
Табберс М.М., Миллиано I, Роузбум М.Г., Беннинга М.А. Эффективны ли Bifidobacterium breve при лечении запоров у детей? Результаты пилотного исследования. Нутр Ж 2011; 10:19. Просмотреть аннотацию.
Tursi A, Brandimarte G, Giorgetti GM, et al. Низкие дозы бальсалазида в сочетании с сильнодействующим пробиотическим препаратом более эффективны, чем один бальсалазид или месалазин при лечении острого язвенного колита легкой или средней степени тяжести. Med Sci Monit 2004; 10: PI126-31. Просмотреть аннотацию.
Вентури А., Джиончетти П., Риццелло Ф. и др. Влияние нового пробиотического препарата на состав фекальной флоры: предварительные данные по поддерживающей терапии больных язвенным колитом. Aliment Pharmacol Ther 1999; 13: 1103-8. Просмотреть аннотацию.
Сяо Дж. З., Такахаши С., Одамаки Т. и др. Чувствительность к антибиотикам штаммов бифидобактерий, распространенных на японском рынке. Biosci Biotechnol Biochem. 2010; 74 (2): 336-42. Просмотреть аннотацию.
Bifidobacterium изменяет микробиоту кишечника и модулирует функциональный метаболизм Т-регуляторных клеток в контексте блокады иммунных контрольных точек
Значение
Многие миллионы людей принимают пробиотики без рецепта, но очень мало известно о том, что они делают и действительно ли они Работа.Здесь мы показываем, что у мышей введение Bifidobacterium , одного из наиболее часто используемых пробиотиков, не только колонизирует кишечник, но и изменяет весь микробиотический ландшафт. Ранее мы обнаружили, что это лечение спасает мышей от воспалительного синдрома со смертельным исходом, вызванного антителом против CTLA-4, ингибитором контрольной точки, который часто вызывает аутоиммунитет у людей, подвергающихся лечению рака. Здесь мы показываем, что этот эффект обусловлен, по крайней мере частично, воздействием этой обработки пробиотиками на регуляторные клетки CD4 + , метаболические и иммуносупрессивные функции которых изменены.Эти регуляторные Т-клетки CD4 + , как известно, являются ключевым механизмом в контроле аутореактивности иммунной системы как у мышей, так и у людей. Таким образом, мы обнаружили прямую связь между лечением пробиотиками и одним из известных основных механизмов контроля избыточных иммунных ответов.
Abstract
Антитела, блокирующие иммунные контрольные точки, которые ослабляют иммунную толерантность, используются для эффективного лечения рака, но они также могут вызывать серьезные иммунные побочные эффекты.Ранее мы обнаружили, что Bifidobacterium может смягчать кишечную иммунопатологию в контексте блокады CTLA-4 у мышей. Здесь мы рассмотрели механизм, лежащий в основе этого процесса. Мы обнаружили, что Bifidobacterium систематически изменяет состав микробиоты кишечника в зависимости от регуляторных Т-клеток (Treg). Более того, это измененное комменсальное сообщество усилило как митохондриальную пригодность, так и опосредованные IL-10 подавляющие функции кишечных Treg, способствуя облегчению колита во время блокады иммунных контрольных точек.
Терапия блокадой иммунных контрольных точек стала очень успешным методом лечения рака. Первое моноклональное антитело (mAb), одобренное для клинического использования, специфично для цитотоксического Т-лимфоцит-ассоциированного белка 4 (CTLA-4) для лечения меланомы (1). Однако применение ингибиторов иммунных контрольных точек (ICI) может вызывать различные и даже фатальные аутоиммунные реакции, из которых диарея и колит являются одними из самых частых и тяжелых (2, 3).
Было показано, что компоненты микробиоты кишечника регулируют противоопухолевый иммунный ответ хозяина (4–7), и несколько исследований показали, что функция кишечной микробиоты модулирует эффективность терапии блокадой иммунных контрольных точек (5, 8, 9).Например, присутствие Bifidobacterium может стимулировать иммунную систему хозяина реагировать на терапию анти-PD-L1 зависимым от CD8 + Т-клетками образом (10).
Хотя эти исследования продемонстрировали роль микробиоты в противоопухолевом иммунитете, основные события, связанные с аутоиммунитетом, индуцированным контрольными точками антител, остаются неуловимыми. В клинике пациенты, перенесшие колит после лечения ICI, содержали состав кишечных бактерий, которые отличаются от таковых у пациентов без колита (11).В недавнем исследовании сообщалось о первом клиническом случае, в котором восстановление кишечной микробиоты с помощью трансплантации фекальной микробиоты успешно помогло избавиться от колита, связанного с ICI (9). Было также показано, что исходный уровень микробиоты кишечника связан с клиническим ответом на ипилимумаб с обогащением Faecalibacterium , что соответствует долгосрочному клиническому эффекту и колиту (12). Ранее мы сообщали, что введение Bifidobacterium ослабляло воспаление кишечника без нарушения противоопухолевой функции CTLA-4 у мышей (13).Здесь мы анализируем фундаментальные принципы, регулирующие взаимосвязь между индуцированной пробиотиками оптимизацией микробиома и результатом блокады CTLA-4. Мы демонстрируем, что Bifidobacterium систематически изменяет состав микробиоты кишечника, значительно увеличивая другие виды пробиотиков, Lactobacillus . Такая оптимизация микробиома зависит от существования регуляторных Т-клеток (Treg). Кроме того, мы обнаружили, что как метаболические, так и подавляющие функции кишечных Treg усиливаются этим измененным комменсальным сообществом, способствуя поддержанию регионального иммунного гомеостаза в условиях блокады CTLA-4.Взятые вместе, наши наблюдения раскрывают иммунологический принцип, управляющий сложными функциями динамики микробиоты, а также механизм переключения с Bifidobacterium на Lactobacillus в улучшении колита, связанного с блокадой иммунных контрольных точек.
Результаты
Bifidobacterium Систематически изменяет микробиоту кишечника в зависимости от Treg.Наше открытие (13), что для модуляции индуцированной CTLA-4 иммунопатологии, опосредованной Bifidobacterium- , требуются Tregs, заставило нас спросить, влияют ли Treg напрямую на микробный состав кишечника ( SI Приложение , рис.S1). Чтобы ответить на этот вопрос, мы использовали мышей Foxp3-DTR, которые несут рецептор дифтерийного токсина на Treg, что делает возможным временное истощение Treg. Мы выделили ДНК из образцов стула и провели секвенирование 16S рРНК, чтобы сравнить кишечное бактериальное сообщество как у контрольных мышей, так и у мышей с истощенным Treg. Анализ главных компонентов показал, что обработка смесью Bifidobacterium приводила к кластерам генотипов, отличным от групп, получавших PBS, как у мышей WT, так и у мышей с истощенным Treg (рис.1 А ). В частности, мы обнаружили, что обработка смесью Bifidobacterium значительно увеличивала численность не только Bifidobacterium , но также Lactobacillus , Kosakonia и Cronobacter у контрольных мышей, в то время как численность этих бактерий снижалась. резко, даже до необнаруживаемых уровней, у мышей с истощенным Treg (Рис. 1 B , Верхний и SI Приложение , Рис. S2 A и B ).
Рис. 1.Bifidobacterium изменяет сообщество кишечной микробиоты. ( A ) График основных координат состава микробиоты с PBS (красный) и Bifidobacterium (синий). ( B ) Процент (среднее ± SEM) от общей бактериальной численности значительно измененных бактерий у контрольных мышей и мышей de-Treg после введения PBS или Bifidobacterium . n.s., не имеет значения. u.d., не обнаруживается. * P <0,05, ** P <0.01, *** P <0,001, **** P <0,0001.
И Bifidobacterium , и Lactobacillus являются хорошо известными пробиотиками, которые, как сообщается, участвуют в гомеостазе кишечника (14, 15). Наши предыдущие данные показали, что Bifidobacterium утратила свою функцию у мышей с истощенным Treg, которым также не хватало Lactobacillus , что свидетельствует о связанном с иммунным статусом взаимодействии между этими двумя типами бактерий. Мы также обнаружили, что обработка Bifidobacterium значительно изменила процентное содержание Clostridium , Anaerostipes , Aporacetigenium и Peptoclostridium у мышей с истощенным Treg, в то время как у мышей с истощенными Treg значительных изменений не было (рис.1 B , Средний ). Кроме того, Bifidobacterium увеличивал численность Enterobacter и Pediococcus как у контрольных мышей, так и у мышей с истощенным Treg (рис. by Bifidobacterium не зависели от иммунной среды кишечника.
штаммов, улучшающих колит, идентифицированных как из
родов Bifidobacterium , так и из Lactobacillus родов.Мы дополнительно протестировали каждый отдельный штамм Bifidobacterium из смеси четырех видов Bifidobacterium , использованных в предыдущих экспериментах. Мы обнаружили, что введение Bifidobacterium breve , но не других штаммов Bifidobacterium или контроля PBS, предотвратило потерю веса у мышей с колитом, получавших αCTLA-4 (рис. 2 A ), демонстрируя, что B. breve , вероятно, является ключевым функциональным штаммом, ответственным за улучшение состояния колита.Поскольку наши данные показали корреляцию между численностью Bifidobacterium и Lactobacillus на уровне рода (рис. 1 B ), мы затем вводили мышам через зонд различные штаммы Lactobacillus , включая Lactobacillus , в том числе Lactobacillus plantarum , Lactobacillus plantarum и Lactobacillus salivarius , чтобы проверить, влияют ли они на предрасположенность к колиту. Мы обнаружили, что лечение L. rhamnosum привело к значительно меньшей потере веса у мышей с колитом (рис.2 В ). В соответствии с этим открытием, окрашивание срезов толстой кишки гематоксилином и эозином (H&E) показало частичное восстановление структуры толстой кишки и меньшее количество лейкоцитов, инфильтрирующих в ткань кишечника как у мышей, обработанных B. breve- , так и у мышей, обработанных L. rhamnosum . Эти два штамма также привели к снижению сывороточных уровней воспалительных цитокинов IL-6, CSF3 и KC. Таким образом, мы можем идентифицировать B. breve и L. rhamnosum как два функциональных штамма, которые улучшают иммунопатологию кишечника во время блокады CTLA-4.
Рис. 2.B. breve и L. rhamnosum являются потенциальными функциональными штаммами для уменьшения воспаления кишечника. ( A ) Процент исходной массы мышей с 2,5% DSS-индуцированным колитом, которым инъецировали αCTLA-4 mAb и лечили контрольным PBS, B. longum , B. bifidum , B. breve или Bifidobacterium angulatum . ( B ) Процент исходной массы мышей с 2,5% DSS-индуцированным колитом, которым инъецировали αCTLA-4 mAb и лечили контрольным PBS, L.plantarum , L. rhamnosum или L. salivarius . Данные представлены как среднее ± стандартная ошибка среднего. n = 5. n.s., не имеет значения. **** П <0,0001. ( C ) Типичные срезы толстой кишки мышей, обработанных контрольным PBS, B. breve или L. rhamnosum (окрашивание H и E; масштабная линейка: 100 мкм). ( D ) Концентрации IL-6, CSF3 и KC в сыворотке мышей, получавших контрольный PBS, B. breve, или L.Рахамнозум . *** P <0,001; **** П <0,0001.
Bifidobacterium усиливает функцию Treg, продвигая самостимулирующую петлю IL-10 / IL-10Rα.Затем мы исследовали влияние Bifidobacterium на кишечные Tregs, которые необходимы для защитной функции Bifidobacterium (13). Сначала мы проанализировали паттерн экспрессии генов Tregs собственной пластинки толстой кишки (LP) у мышей, обработанных Bifidobacterium и обработанных PBS.График вулкана показывает, что обработка Bifidobacterium увеличила несколько ключевых генов, связанных с воспалением, таких как Il10rα , Cxcr5 и Il17rα (фиг. 3 A ). Мы также подтвердили с помощью проточной цитометрии, что экспрессия IL-10Rα в Treg LP толстой кишки увеличивается после обработки Bifidobacterium (рис. 3 B и SI, приложение , рис. S3), а уровень внутриклеточного IL-10 был также увеличились в этих Treg, но не в других клетках (рис.3 C и SI Приложение , рис. S4). Эти данные показывают, что Bifidobacterium способствует самостимулирующей петле IL-10 / IL-10Rα в кишечных Treg.
Рис. 3.IL-10 и IL-22 необходимы для функции Bifidobacterium . ( A ) Вулканический график значительно измененных генов в Treg LP толстой кишки, сравнивая мышей, получавших Bifidobacterium , с мышами, получавшими PBS, в условиях блокады CTLA-4. ( B и C ) Анализ проточной цитометрии IL-10Rα ( B ) и IL-10 ( C ) в Treg LP толстой кишки, выделенных от мышей, которым инъецировали CTLA-4.Данные взяты из двух независимых экспериментов. n = 2 мыши на группу в каждом эксперименте. n.s., не значимо, * P <0,05, ** P <0,01, **** P <0,0001. ( D ) Анализ супрессии Treg, выполняемый путем совместного культивирования клеток Teff селезенки, антигенпрезентирующих клеток и Treg толстой кишки от мышей, обработанных PBS или Bifidobacterium , через 4 дня после получения антитела против CTLA-4. Данные взяты из трех независимых экспериментов. * P <0.05. ( E ) Процент исходной массы мышей WT и Il-10 KO с 2,5% DSS-индуцированным колитом, подвергнутых инъекции IgG или αIL-22. Мышей лечили αCTLA-4 mAb и Bifidobacterium . n = 5. *** P <0,001, **** P <0,0001. ( F и G ) Типичные срезы ткани толстой кишки мышей WT, обработанных Bifidobacterium , мышей WT, получавших инъекцию αIL-22, и мышей IL-10 KO, обработанных IgG, на 10-й день после анти-CTLA-4 инъекция антител и введение DSS (окрашивание H и E; шкала: 100 мкм) ( F ) и концентрации цитокинов в сыворотке ( G ).* P <0,05, ** P <0,01. ( H ) Процент начального веса инъецированных αIL-22 мышей Il-10 KO с 2,5% DSS-индуцированным колитом, подвергнутых обработке mAb против CTLA-4 и зондированию PBS или Bifidobacterium . Данные представляют собой среднее значение ± стандартная ошибка среднего. n = 5. n.s., не имеет значения. ( I ) Гистологические оценки мышей, получавших PBS или Bifidobacterium .
Поскольку передача сигналов IL-10 важна для усиления функции Treg и поддержания гомеостаза кишечника (16⇓ – 18), мы затем исследовали супрессивную функцию Treg толстой кишки in vitro.Мы обнаружили, что эффекторные Т-клетки, которые были совместно культивированы с Treg, обработанными Bifidobacterium , показали меньшую пролиферацию, чем те, которые были совместно культивированы с Treg, обработанными PBS, что указывает на то, что этот тип кишечных микробов усиливает их подавляющую функцию (Рис. , рис. S5).
И IL-10, и IL-22 участвуют в улучшающей функции колита
Bifidobacterium .Для дальнейшего анализа роли IL-10 в функции Bifidobacterium , мы использовали IL-10 нокаут-мышей (KO) для анализа симптомов колита в условиях блокады CTLA-4 обработкой Bifidobacterium .Мы наблюдали более сильную потерю веса у мышей Il-10 KO по сравнению с мышами дикого типа (WT), подвергнутыми такой же обработке (фиг. 3 E , синяя линия). IL-22 разделяет иммунную регуляторную функцию с IL-10R и играет важную роль в поддержании гомеостаза кишечника (16, 18). Таким образом, мы использовали IL-22-нейтрализующее антитело для тестирования эффекта удаления этого цитокина на ремиссию колита, опосредованного Bifidobacterium , во время блокады CTLA-4. Мы обнаружили, что мыши, получавшие антитела, потеряли больше веса, чем мыши, получавшие нерелевантное антитело.В частности, средний вес мышей, получавших Bifidobacterium , снизился с 90% от исходного веса в контрольной группе до ~ 70% от исходного веса в группе, получавшей инъекции анти-IL-22, на 10 день после DSS (сульфат декстрана). натрия) (рис.3 E , красная линия). В соответствии с этим открытием, окрашивание срезов толстой кишки H&E показало большую инфильтрацию лейкоцитами и более серьезное повреждение структуры кишечника у мышей, обработанных антителом против IL-22, или мышей Il-10 KO (рис.3 Ф ). Обработка анти-IL-22 и нокаут IL-10 также увеличивали сывороточные уровни воспалительных цитокинов IL-6, CSF3 и KC (фиг. 3 G ).
Важно отметить, что мы обнаружили, что при применении блокады IL-22 к мышам Il-10 KO, мыши, обработанные Bifidobacterium , показали сильную потерю веса, сравнимую с таковой у контрольных мышей, получавших PBS (фиг. 3 H ). Сопоставимые гистологические баллы также наблюдались в двух группах (рис.3 I ). Вместе эти результаты показывают, что как IL-22, так и IL-10 необходимы для функции Bifidobacterium в улучшении иммунопатологии кишечника.
Bifidobacterium Усиливает митохондриальный метаболизм Treg-клеток.Помимо воздействия на функцию иммунных клеток, микробиота кишечника также может влиять на метаболизм клетки-хозяина (19, 20). Мы выполнили профилирование метаболитов на основе масс-спектрометрии с сывороткой мышей, обработанных Bifidobacterium , и контрольных мышей (21).Интересно, что мы обнаружили, что лечение Bifidobacterium увеличивало сывороточный уровень субериновой кислоты (рис. 4 A ), кислоты, которая отражает митохондриальную активность и часто выявляется у пациентов с нарушениями липидного обмена (22). Затем мы оценили данные экспрессии генов из отсортированных Treg LP толстой кишки с помощью анализа Gene Ontology (GO). В соответствии с вышеизложенными результатами, мы обнаружили обогащение биологических путей, связанных как с метаболическими процессами, так и с митохондриальной организацией в группе, получавшей Bifidobacterium , по сравнению с группой, получавшей лечение Bifidobacterium .контрольная группа (рис. 4 Б ). Обогащенный анализ набора генов (GSEA) показал, что четыре набора генов, напрямую связанных с метаболизмом, включая «метаболизм желчных кислот», «пероксисому», «метаболизм жирных кислот» и «гомеостаз холестерина», представляют собой сигнатуру активированного гена в Tregs толстой кишки. после обработки Bifidobacterium (рис. 4 C ).
Рис. 4.Bifidobacterium влияет на митохондриальный метаболизм Treg толстой кишки. ( A ) Концентрации субериновой кислоты в сыворотке мышей, получавших PBS или Bifidobacterium. * P <0,05. ( B ) GO анализ существенно нарушенных биологических процессов. ( C ) GSEA толстой кишки Tregs. На диаграмме показан GSEA для четырех наборов генов, активированных в группах, обработанных Bifidobacterium (слева, Bifidobacterium ; справа, PBS). Вертикальная ось на верхнем графике показывает оценку обогащения (ES) для генов в каждом наборе генов. График штрих-кода указывает положение генов в каждом наборе генов. NES, нормализованная ES; FDR, коэффициент ложного обнаружения.( D ) Митохондриальная масса Tregs LP толстой кишки ( n = 5), как обнаружено с помощью мечения MitoTracker Deep Red FM и проточной цитометрии. * P <0,05. ( E ) Митохондриальный стресс Tregs LP толстой кишки ( n = 5), обнаруженный с помощью мечения MitoTracker Red CMXROS и проточной цитометрии. * P <0,05. ( F ) Паттерн экспрессии генов, связанных с митохондриями, в обработанных Bifidobacterium и обработанных PBS LP Treg.
Чтобы исследовать, влияет ли Bifidobacterium на объем и функцию Treg в митохондриях, мы окрашивали клетки флуоресцентными зондами для мониторинга объема митохондрий и мембранного потенциала.Данные проточной цитометрии показали, что Treg в группе, обработанной Bifidobacterium , демонстрировали увеличение как объема митохондрий, так и митохондриального стресса (фиг. 4 D и E ) по сравнению с таковыми в группе PBS. В соответствии с этим открытием, множественные гены, связанные с функцией митохондрий и структурными компонентами митохондрий, были значительно активированы обработкой Bifidobacterium (фиг. 4 F ). В совокупности эти результаты демонстрируют, что Bifidobacterium модулирует метаболические процессы и усиливает митохондриальную активность в Treg кишечника.
Обсуждение
В этом исследовании мы использовали модель колита DSS у мышей в условиях блокады иммунных контрольных точек, чтобы изучить эффекты Bifidobacterium как на комменсальное сообщество, так и на иммунную систему хозяина. Важно отметить, что мы обнаружили, что введение Bifidobacterium вызывает системные изменения в микробиоте кишечника. Более того, на эту модуляцию влияет иммунная регуляторная среда слизистой оболочки, определяемая с помощью Treg.
Интересно, что мы обнаружили, что введение Bifidobacterium значительно изменило численность Lactobacillus , предполагая, что Bifidobacterium способствует ремиссии кишечного воспаления, составляя благоприятную экосистему кишечника с другими таксонами, связанными с пробиотической активностью.Примечательно, что низкий процент колонизации Bifidobacterium (∼0,002%) может привести к обогащению Lactobacillus , достигая ∼10% от общего количества комменсальных бактерий (рис.1 B ), что указывает на роль Bifidobacteria как вид-первопроходец, позволивший колонизировать другие, более многочисленные виды пробиотиков. Более того, мы обнаружили, что этот пробиотический ретранслятор с Bifidobacterium на Lactobacillus также чувствителен к статусу воспаления кишечника, установленному Treg.Идентифицировав B. breve и L. rhamnosum как два конкретных функциональных штамма из родов Bifidobacterium и Lactobacillus , мы дополнительно подтвердили положительную роль этих бактерий в контроле вызванной CTLA-4 кишечной токсичности.
Таким образом, мы обнаружили, что введение Bifidobacterium мышам глубоко изменяет их микробиом, указывая на то, что это динамичная и взаимосвязанная экосистема. В отношении влияния этих бактерий на подавление вредных эффектов анти-CTLA-4 / повреждения кишечника мы обнаружили как повышенную экспрессию IL-10Ra, так и повышенную продукцию IL-10 в кишечных Treg, предполагая, что Bifidobacterium может прямо или косвенно усиливать подавляющая функция Tregs за счет стимуляции сигнальной петли IL-10 / IL10Ra в Treg без изменения их количества.Более того, мы показываем, что этот процесс связан с повышенной митохондриальной активностью в этих Treg, обеспечивая метаболическую связь с их усиленной функцией в этой системе.
Материалы и методы
Мыши. Мыши
Il-10 KO ( Il-10 — / — ; C57BL / 6-Il10tm1Cgn) были приобретены в лаборатории Джексона. Все эксперименты проводились на самках мышей в возрасте от 6 до 14 недель. Мышей содержали в специальном помещении, свободном от патогенов, в Шанхайском университете Цзяо Тонг или Стэнфордском университете.Эксперименты на мышах были одобрены Комитетом по институциональному уходу и использованию животных Медицинской школы Шанхайского университета Цзяо Тонг и Стэнфордского университета.
Модель колита DSS в условиях блокады CTLA-4.
Между 2% и 4% DSS (MP Biomedicals) добавляли к питьевой воде мышей на 7-12 дней. Изменения веса контролировали каждый день. Для манипуляции кишечным комменсалом мыши получали ванкомицин (0,5 г / л; Sigma-Aldrich) по крайней мере за 14 дней до введения DSS.Мышам вводили 200 мкг mAb против CTLA-4 (BioXCell, клон 9D9) или изотипического контроля в начале введения DSS.
Гистологический анализ.
Ткани толстой кишки фиксировали 4% параформальдегидом, заливали парафином, делали срезы от 3 до 6 мкм и окрашивали H&E. Каждому сегменту была присвоена оценка от 0 до 4 по пяти критериям: тяжесть воспаления, процент площади, пораженной воспалением, степень гиперплазии, процент площади, пораженной гиперпластическими изменениями, и изъязвление.
Введение пробиотиков.
Смесь четырех видов Bifidobacterium , состоящих из B.bifidum , B. longum , B. lactis и B. breve (Seeking Health) или отдельных штаммов пробиотиков, ресуспендировали в PBS. Каждая мышь получала 1 × 10 9 КОЕ бактерий через желудочный зонд. При колите DSS пробиотики вводили до лечения DSS.
Экстракция фекальной ДНК и анализ последовательности 16S.
Геномная ДНК была выделена из образцов фекалий (собранных через 4 дня после перорального введения пробиотиков) с использованием набора для выделения ДНК PowerSoil (MO BIO Laboratories) в соответствии с инструкциями производителя. Универсальные эубактериальные праймеры 16S 515F GTGCCAGCMGCCGCGGTAA и 806R GGACTACHVGGGTWTCTAAT использовали для оценки микробной экологии каждого образца в системе секвенирования Illumina HiSeq 2500. Данные последовательности, полученные в процессе секвенирования, были обработаны с использованием запатентованного конвейера анализа (MR DNA).Затем OTU были таксономически классифицированы с использованием BLASTn по отношению к курируемой базе данных GreenGenes / Ribosomal Database Project / Национального центра биотехнологической базы данных.
Выделение кишечных лимфоцитов LP.
LP-лимфоцитов были выделены, как описано ранее, с простой модификацией (19). Вкратце, мышей умерщвляли, толстую кишку удаляли и открывали в продольном направлении. Кишечник тщательно промывали PBS и разрезали на кусочки размером 1,5 см. Кишечник встряхивали в PBS, содержащем 1 мМ DTT, 30 мМ EDTA и 10 мМ Hepes, при 37 ° C в течение 10 мин.Затем кишечник встряхивали в PBS, содержащем 30 мМ EDTA и 10 мМ Hepes, при 37 ° C в течение 10 мин. После промывки полной средой RPMI 1640 ткани переваривали в среде RPMI 1640, содержащей 16% коллагеназы VIII (Sigma-Aldrich; 50 KU) и ДНКазу I (Sigma Aldrich; 90 мг / мл), при 37 ° C в течение 55 минут. Затем клеточные суспензии от ферментного переваривания наносили на градиент Percoll (GE Healthcare) (для лимфоцитов: 40% Percoll вверху, 80% Percoll внизу) центрифугированием при 2500 об / мин в течение 25 минут при комнатной температуре.Лимфоциты собирали из интерфазы и дважды промывали 0,5% BSA-PBS.
Проточная цитометрия.
Клетки окрашивали указанными конъюгированными с флуорохромом антителами в PBS, содержащем 0,5% BSA, для анализа поверхностных маркеров. Проточный цитометрический анализ выполняли с использованием проточного цитометра Fortessa (BD Biosciences) с программным обеспечением FlowJo.
Окрашивание внутриклеточных цитокинов.
Уровни внутриклеточной экспрессии IL-17A, IL-22 и IL-10 в Т-клетках CD4 + анализировали с помощью набора буферов для окрашивания Foxp3 / фактора транскрипции (Invitrogen) в соответствии с инструкциями производителя.Вкратце, кишечные LP инкубировали со смесью для стимуляции клеток и ингибитором транспорта белка (Invitrogen) в полной RPMI 1640 при 37 ° C в течение 5 часов. Окрашивание поверхности проводили при 4 ° C в течение 30 мин. После фиксации и обработки для повышения проницаемости проводили внутриклеточное окрашивание анти-IL-17A (eBioscience), анти-IL-22 (eBioscience), анти-IL-10 (BD Biosciences), анти-Foxp3 (eBioscience) и анти-RORγt. (eBioscience) антитела в течение 1 ч. Данные были получены с помощью проточного цитометра BD Biosciences Fortessa и проанализированы с помощью программного обеспечения FlowJo.
Анализ цитокинов сыворотки.
Образцы крови собирали на 6-7 день после индукции колита с помощью DSS. После свертывания при комнатной температуре в течение не менее 30 минут сыворотку отделяли при RCF 1200 в течение 10 минут с помощью центрифуги. Измерения цитокинов проводили в соответствии с инструкциями в руководстве по системе Luminex.
Анализ данных секвенирования РНК.
Каждый отдельный образец имел в среднем 35 миллионов считываний парных концов по 75 пар оснований. Fastqc (версия 0.11.4) использовался для оценки качества секвенирования.Затем считанные данные были сопоставлены с человеческим (hg19) транскриптомом с использованием Bowtie версии 2.2.7 со сплайсинговыми соединениями, определенными в файле GTF (полученном из UCSC). В среднем 65% считываний были сопоставлены с эталонным транскриптомом. Экспрессию на уровне гена определяли путем расчета считываний на килобазу на миллион выровненных считываний и необработанных подсчетов с использованием RSEM версии 1.2.30. Дифференциально экспрессируемые гены с кратными изменениями были дополнительно обнаружены с помощью DEseq2 версии 1.10.1 для двух сопоставимых условий.Анализ GO проводился с помощью онлайн-инструмента Дэвида (https://david.ncifcrf.gov). GSEA проводили с использованием модели с предварительным ранжированием, и наборы генов с FDR ниже 25% считались значительным обогащением.
Анализ подавления Treg.
Эффекторные Т-клетки (CD4 + TCRβ + GFP — CD44 + CD62L —) и не-Т-клетки (TCRβ —) были очищены методом проточной цитометрии, отсортировав клетки из селезенок C57B. / 6 мышей. Т-клетки метили CellTrace Violet (Invitrogen; 5 мкм).Не-Т-клетки инкубировали с митомицином C (Sigma-Aldrich; 50 мкг / мл) при 37 ° C в течение 30 мин. Treg (CD45 + CD4 + TCRβ + GFP + ) были отсортированы из LP толстой кишки мышей Foxp3-GFP . Treg и меченые эффекторные Т-клетки (Teffs) помещали в 96-луночные планшеты при соотношениях Treg: Teff 1: 8, 1:16, 1:32 и 1:64, а затем в каждую лунку добавляли не-Т-клетки. в три раза больше числа ячеек Teff. Клетки культивировали с анти-CD3ε (BD Biosciences; клон 2C11) при 0.1 мкг / мл в течение 3 дней. Подавляющую активность Treg оценивали как пролиферацию клеток Teff на основе разведения цитозольного красителя CellTrace Violet.
Митохондриальный анализ.
Лимфоциты LP толстой кишки выделяли и затем окрашивали маркерами клеточной поверхности. После двух промывок 0,5% BSA-PBS клетки инкубировали с митохондриальным красителем (Invitrogen) (для Mito Tracker Red FM, 50 нМ; для Mito Tracker Red CMXRos, 100 нМ) при 37 ° C в течение 25 мин.
Метаболомический анализ.
Образцы сыворотки экстрагировали метанолом, и осажденный белок осаждали центрифугированием. Затем экстракты сушили и восстанавливали в 50% метаноле. Затем образцы анализировали методом жидкостной хроматографии и масс-спектрометрии (ЖХ-МС) с использованием Agilent 6545 Q-TOF с использованием трех методов, включая положительную и отрицательную обратную фазу ЖХ-МС и хроматографию гидрофильного взаимодействия. Затем была проведена идентификация пиков с использованием библиотеки стандартов масс-спектрометрии и соответствующего программного обеспечения от IROA Technologies.
Статистический анализ.
Статистический анализ был выполнен с использованием GraphPad Prism версии 7.00.
Доступность данных.
Все данные исследования включены в основной текст и SI Приложение .
Благодарности
Мы благодарим Шашуан Чжан, Лей Дин, Ру Фенг, Лей Чен, Гоцзюнь Цюй, Бин Су, Шуо Хан, Юэ-сю Цзянь, Уильяма Ван Треурена и Курта Фишера за полезные обсуждения и техническую помощь, а также Центр химического анализа метаболитов ChEM-H Стэнфордского университета.Это исследование было поддержано грантами Национальной программы ключевых исследований и разработок Китая (SQ2018YFA0
-01), Национального фонда естественных наук Китая (82071852, 81771739), Программы для профессоров специальных назначений (восточных ученых) Шанхайских институтов Комитет по высшему образованию и технологиям муниципалитета Шанхая (18JC1414100, 20410713800, FW), HHMI и Институт иммунотерапии рака (MMD).Сноски
Авторы: M.Доктор медицины и Ф.В. разработали исследование; S.S., L.L., W.L., Q.Y., J.G. и A.M.R. проведенное исследование; Z.L., Q.L., M.A.F., J.L.S. и D.D. внесены новые реагенты / аналитические инструменты; Z.L., Q.L., M.A.F., J.L.S., D.D. и M.M.D. проанализированные данные; и S.S., M.M.D. и F.W. написали статью.
Рецензенты: ХК, Детская исследовательская больница Св. Иуды; и J.R., Медицинский центр Университета Вандербильта.
Авторы заявляют об отсутствии конкурирующей заинтересованности.
Эта статья содержит вспомогательную информацию на сайте https: // www.pnas.org/lookup/suppl/doi:10.1073/pnas.1921223117/-/DCSupplemental.
- Copyright © 2020 Автор (ы). Опубликовано PNAS.
Преимущества, побочные эффекты и дозировка
Bifidobacterium, вид «хороших бактерий», — первые бактерии, которые колонизируют кишечник у младенцев, проходя через родовые пути. Считается, что эти бактерии, также известные как пробиотики, помогают пищеварению.
За последние двадцать лет исследования о пользе хороших бактерий, таких как Bifidobacterium, резко возросли.В настоящее время исследования показали, что Bifidobacterium играет роль в повышении общего иммунитета, уменьшении и лечении желудочно-кишечных инфекций, а также в улучшении таких состояний, как диарея, запор и экзема.
Обычно известен как
- B. Bifidum
- Б. Бреве
- Б. Инфантис
- Б. молочная
- Б. Лонгум
- Бифидо
- Bifidobacterium longum
- Бифид
- Пробиотик
Польза для здоровья
Bifidobacterium предлагает широкий спектр преимуществ для здоровья.Фактически, его присутствие и изобилие были указаны как маркер здоровья. Доктор Сара Рахал, доктор медицины, сертифицированный детский невролог и практик интегративной медицины, говорит: «Бифидобактерии приносят множество преимуществ для здоровья кишечника, мозга, метаболической и иммунной систем».
Лаура Портер / Веривелл.Повышение иммунитета
Ряд исследований показывают, что здоровье кишечника с раннего детства может играть роль в предотвращении связанных со здоровьем состояний и факторов риска в более позднем возрасте.Исследования связывают изменение кишечных бактерий (или микробиома) с множеством заболеваний, включая аутоиммунные заболевания, такие как целиакия и диабет 1 типа, метаболический синдром, аллергии, астма и воспалительные заболевания кишечника.
Целый ряд факторов может способствовать здоровью кишечника. Здоровые бактерии являются одним из этих факторов, которые, как было установлено, поддерживают здоровье кишечника, улучшают иммунную функцию и, возможно, снижают риск некоторых заболеваний.Исследователи полагают, что защитная способность бифидобактерий против болезней раннего возраста заключается в том, что они действуют посредством специфической иммунной стимуляции и подкисления кишечной среды за счет производства короткоцепочечных жирных кислот (SCFA) и лактата.
Снижение и лечение желудочно-кишечных инфекций
Пробиотики часто используются вместе с антибиотиками, чтобы снизить риск желудочно-кишечных инфекций и предотвратить гибель полезных бактерий. Кроме того, некоторые исследования показывают, что лечение пробиотиками, содержащими Bifidobacterium, может помочь в лечении инфекций, таких как Clostridium difficile, путем уменьшения диареи.
Снижение риска колоректального рака
Некоторые исследования на животных показали, что при приеме с пребиотиком определенные штаммы Bifidobacterium, такие как B. animalis , B. longum и B. breve, , могут снизить риск рецидива рака толстой кишки.
Улучшение диареи и запора
Синдром раздраженного кишечника (СРК) часто характеризуется болью или дискомфортом в животе и связан с изменениями частоты и / или консистенции стула.Это может привести к диарее и / или запору. В Руководстве по клинической практике о СРК сделан вывод о том, что пробиотики могут улучшить общие симптомы у пациентов с СРК, на основании некоторых рандомизированных клинических контрольных испытаний.
Американская академия семейных врачей заявляет, что «пробиотики могут снизить частоту диареи, связанной с антибиотиками, продолжительность и тяжесть инфекционной диареи всех причин, а также тяжесть боли и вздутия живота у пациентов с СРК». Преимущества, по-видимому, зависят от используемого типа, состава и введенного количества.
Профилактика экземы
Многие исследования показали, что использование пробиотиков, содержащих штаммы Bifidobacterium, которые дают матери во время беременности и кормления грудью, а также младенцам, может предотвратить экзему у младенцев и детей. Когда дело доходит до лечения экземы, полезное использование пробиотиков неоднозначно, и необходимы дополнительные исследования, чтобы определить преимущества. Прежде чем давать ребенку какие-либо добавки, вы всегда должны сначала проконсультироваться с врачом.
Повышает биодоступность некоторых минералов
Употребление бифидобактериальных пищевых продуктов, иначе называемых функциональными продуктами питания, может улучшить биодоступность определенных минералов, таких как кальций, цинк и железо.
Возможные побочные эффекты
Люди с сопутствующими заболеваниями, особенно с ослабленным иммунитетом или расстройствами пищеварения, могут быть более чувствительны к пробиотикам (повышая риск заражения у некоторых), и поэтому всегда должны обсудить это со своей медицинской бригадой перед тем, как начать. Доктор Рахал говорит: «В целом, у многих здоровых людей могут возникнуть преходящие симптомы со стороны ЖКТ, такие как газы, запор или диарея, когда организм приспосабливается к изменениям бактериальной флоры.”
Дозировка и подготовка
Пробиотики маркируются на основе колониеобразующих единиц (КОЕ). Это указывает на то, насколько плотными или мощными являются живые бактерии. Более высокое количество КОЕ в пробиотике может означать, что он оказывает более сильное влияние на рост полезных бактерий в кишечной флоре.
Некоторые компании предполагают, что их пробиотик превосходит другие по количеству КОЕ, но доктор Рахал говорит: «Конкретные дозировки в пересчете на КОЕ менее изучены и, вероятно, менее важны.Вместо этого более важно найти высококачественный продукт, который был должным образом обработан и хранился, чтобы у вас был продукт с большой долей жизнеспособных живых бактерий ».
Продукты, которые не были приготовлены и хранились должным образом, могут оставить у вас мертвые бактерии, что противоречит цели приема пробиотиков и может быть пустой тратой денег. Чтобы этого не произошло, некоторые компании инкапсулируют свои продукты.
Характеристики эффективного пробиотика
Чтобы пробиотик был эффективным, он должен удовлетворять нескольким условиям:
- Не должно быть токсичным или патогенным.
- Он должен сохранять характеристики, которые оказались полезными для хоста (человека, который его использует).
- Он должен содержать достаточно большое количество жизнеспособных микроорганизмов на единицу.
- Он должен уметь расти и выживать в процессе производства, а также проходить через желудок и тонкий кишечник.
- Он должен оставаться живым (жизнеспособным) во время хранения и использования.
Если вы все же решили начать прием добавок, начинайте медленно и постепенно увеличивайте дозу.Существует широкий диапазон дозировок, и слишком большое их начало может вызвать некоторый дискомфорт в желудке. Спросите своего врача или диетолога, с чего начать.
Что искать
Всегда лучше получать здоровую дозу пробиотиков, употребляя цельные продукты, богатые полезными бактериями. «Ферментированные продукты и напитки, такие как квашеная капуста, кимчи, кефир, чайный гриб, йогурт и культивированные овощи, являются отличным источником живых и активных пробиотиков», — говорит доктор Рахал. Старайтесь ежедневно есть разнообразные эти продукты.
Если вы хотите принимать добавки, имейте в виду, что существует много разных типов пробиотических штаммов, и каждый из них имеет свои особенности. При поиске пробиотика, специфичного для Bifidobacterium, ищите полное название пробиотика, которое включает род, вид и штамм. Например, в « B. adolescentis 22L» буква «B.» обозначает род Bifidobacterium. Вид — adolescentis , штамм — 22L.
Имейте в виду, что очень важно выбрать правильный вид живых бактерий в правильных пропорциях.И очень важно выбрать качественный пробиотик из надежного источника.
Некоторые врачи поддерживают отношения с лабораториями, чтобы предоставлять надежные высококачественные добавки своим пациентам, которые в них нуждаются. Если вы не уверены, какой тип пробиотика купить и в каком количестве, обсудите это со своей медицинской бригадой.
Будьте особенно осторожны с лиофилизированными пробиотическими добавками. Тем не менее, их можно использовать. «Проблема заключается в том, что они быстро разлагаются под воздействием влаги и поэтому могут не храниться очень долго, несмотря на рекламу», — говорит д-р.Рахал.
При поиске цельных продуктов, содержащих бифидобактерии, по возможности выбирайте органические йогурты из травяного откорма. Вы также можете попробовать чайный гриб (ферментированный чай), но следите за размером порции, так как многие сорта могут содержать хорошее количество сахара. Кефир, кисломолочный продукт, представляющий собой нечто среднее между йогуртом и молоком, может быть хорошим вариантом завтрака. Другие цельные продукты включают ферментированные овощи, такие как квашеная капуста, соленые огурцы, кимчи, а также сметана, пахта, мисо и яблочный уксус.
Хранилище
Пробиотики чувствительны к свету, теплу и влаге. Пробиотик хорошего качества следует хранить в темной стеклянной бутылке, чтобы предотвратить гибель бактерий. Большинство типов пробиотиков необходимо хранить в холодильнике. Всегда следуйте инструкциям производителя для оптимального хранения.
Общие вопросы
При выборе добавки с пробиотиками у многих людей возникают вопросы, особенно относительно пробиотиков по сравнению с пребиотиками, а также о том, подходят ли пробиотики для детей.
В чем разница между пробиотиком и пребиотиком?
Пребиотики — это разновидность пищевых волокон, которые служат пищей для пробиотиков. Доктор Рахал говорит: «Как только кишечник будет заселен здоровой флорой (пробиотиками), пребиотики будут поддерживать здоровье и воспроизводство этих видов».
Некоторые примеры продуктов, содержащих пребиотики, включают злаки, спаржу, ягоды, грибы, бананы, чеснок, инулин (волокна корня цикория), артишоки, арбуз, грейпфрут, ячмень, овес, морские водоросли, бобовые и лук.
Некоторые добавки называются «симбиотическими», что означает, что они содержат как пребиотики, так и пробиотики. Некоторые эксперты утверждают, что прием пробиотиков бесполезен, если вы также не употребляете пребиотики.
Следует ли моему ребенку принимать пробиотики?
Дети могут есть продукты, содержащие пробиотики, такие как йогурт, сметана, кефир, мисо и некоторые сыры. Если вы думаете о добавках, доктор Рахал советует «не добавлять какие-либо добавки к режиму питания ребенка без размышлений и планирования относительно того, почему это делается, цели здоровья и запланированного курса».И делать это по согласованию с вашим практикующим врачом ».
Слово Verywell
Если вы думаете о добавлении пробиотика Bifidobacterium, проконсультируйтесь с врачом о том, сколько и какой тип вам следует принимать. Имейте в виду, что разные штаммы полезны при разных типах заболеваний и что наиболее важным фактором является качество бактерий, а не обязательно их количество. Если вы беременны, кормите грудью или болеете в анамнезе, проконсультируйтесь с врачом, прежде чем начинать принимать какие-либо добавки.
Bifidobacterium Bacteremia: уникальное послеоперационное осложнение
Аннотация
Фон
У 54-летней женщины с рецидивирующей плоскоклеточной карциномой заднего прохода, леченной абдоминоперинеальной резекцией, развивается бактериемия Bifidobacterium breve после образования подвздошного канала, осложненного кишечной утечкой.
Сводка
Bifidobacterium bacteri a — это грамположительные неподвижные разветвленные анаэробные бактерии, обнаруженные в желудочно-кишечном тракте.В последнее время он широко используется в безрецептурных пробиотических препаратах и является редкой причиной анаэробной бактериемии. Наш случай представляет собой 54-летнюю женщину с рецидивирующей плоскоклеточной карциномой заднего прохода, которой была проведена абдоминоперинеальная резекция, осложненная лучевым циститом и проведена плановая отведение мочи через формирование подвздошного канала. За этим последовала кишечная утечка, вызванная пропущенной энтеротомией, в связи с чем ей потребовалось дополнительное хирургическое вмешательство. Течение больного в стационаре осложнилось бактериемией Bifidobacterium .В анамнезе у нее не было пробиотиков до хирургического вмешательства, и поэтому источником ее бактериемии, вероятно, была транслокация бактерий через нарушенный барьер желудочно-кишечного тракта или значительная утечка кишечного вещества в условиях пропущенной энтеротомии. Клиническое состояние пациента улучшилось, и посевы стали отрицательными после того, как был достигнут контроль источника и были использованы антибиотики широкого спектра действия.
Заключение
Bifidobacterium bacteri a — редкая причина бактериемии.Большинство пациентов, у которых развивается бактериемия, моложе шести недель или старше 65 лет, и большинство из них страдают патологией желудочно-кишечного тракта или имеют ослабленный иммунитет. Предполагаемая этиология этих случаев инфекции кровотока связана с транслокацией бактерий из желудочно-кишечного тракта, что приводит к бактериемии. Пациентка, описанная в этом отчете, соответствует этим характеристикам, так как у нее было диагностировано злокачественное новообразование и грубое желудочно-кишечное заражение брюшной полости.К счастью, большинство пациентов с бактериемией Bifidobacterium выздоравливают после своих инфекций. Антибиотики являются основным периодом лечения, и в этом случае эмпирически использовалась обычная схема широкого спектра действия.
Ключевые слова
Бифидобактерии, бактериемия, послеоперационная, абдоминальная хирургия
Описание корпуса
Нашей пациентом является женщина 54 лет с историей болезни диабета, гипертонии, сердечной недостаточности с сохраненной фракцией выброса и статуса плоскоклеточного рака заднего прохода после удаления и химиолучевой терапии за 20 лет до обращения.У нее был рецидив промежности за 18 месяцев до госпитализации, после чего была выполнена лапароскопическая абдоминальная резекция промежности, задняя вагинэктомия, резекция тонкой кишки и конечная колостомия с помощью ротационного лоскута правой тонкой мышцы бедра. Начальное послеоперационное течение осложнилось расхождением лоскутной раны. После первоначальной химиолучевой терапии за 20 лет до обращения у нее возник постоянный дискомфорт при мочеиспускании и недержание мочи, вторичные по отношению к лучевому циститу. Из-за невосприимчивых симптомов, несмотря на цистоскопию и инъекции ботокса, она решила пройти отведение мочи с помощью цистэктомии и формирования подвздошной кишки.Процедура осложнилась плотными спаечными процессами и предшествующим облучением таза. Во время операции серозное повреждение терминального отдела подвздошной кишки было восстановлено, и сегмент тонкой кишки был резецирован из-за беспокойства о жизнеспособности тканей. От цистэктомии отказались, поскольку выполнить полную цистэктомию было сложно. На шестые сутки после операции ее состояние ухудшилось. У нее развился респираторный дистресс, и выход в хирургический дренаж в брюшной полости изменился по характеру, который оказался сочным. Из-за опасений по поводу несостоятельности анастомоза были назначены антибиотики широкого спектра действия, и ее срочно отправили на диагностическую лапаротомию.Большой объем сока был обнаружен в брюшной полости, и энтеротомия была обнаружена внутри спутанной петли тонкой кишки, глубоко в тазу. Область была резецирована и завершена илеостомия. Пациент был экстубирован на 2-й день после операции, и вазопрессоры были отлучены от груди. Несмотря на то, что у нее диагностировали ограниченную утечку мочи, поскольку ее абдоминальный дренаж имел большой объем выделения с повышенным уровнем креатинина, она прогрессировала соответствующим образом. В культуре крови продолжили расти Bifidobacterium breve .Она продолжала получать антибиотики широкого спектра действия: Ванкомицин и Зосин. Послеоперационный день 7 был сужен только до Зосин, и она была переведена из хирургического отделения интенсивной терапии послеоперационного дня 9. Антибиотики были закончены после операции 12. Послеоперационный день у нее началась лихорадка, и было возобновлено покрытие широкого спектра. Повторные посевы были положительными только на Candida albicans в ее моче. Обследована инфекционная болезнь, проходит трехнедельный курс Зосина и 10-дневный курс флуконазола.
Обсуждение
Виды Bifidobacterium — обычная флора желудочно-кишечного тракта, мочеполовых путей и влагалища человека. Несмотря на то, что они составляют 80% микробиома грудного ребенка и от 6 до 8% фекальной флоры взрослого, Bifidobacterium видов представляют маловероятную причину бактериемии, составляя менее 1–3% положительных анаэробных культур крови. 1,10 По состоянию на 2015 г. было зарегистрировано только 22 случая бактериемии Bifidobacterium . 10
Bifidobacterium , анаэробная грамположительная палочка, наиболее широко известна своим использованием в качестве пробиотика и часто назначается недоношенным детям с низкой массой тела при рождении для предотвращения некротического энтероколита (NEC). Двойное слепое рандомизированное контрольное исследование 2011 г., в котором оценивали Lactobacillus casei и Bifidobacterium breve , показало, что введение пробиотиков снижает частоту возникновения НЭК. 2 Интересно, что терапия с использованием режима, включающего Bifidobacterium breve , снижает частоту энтероколита, пневмонии и бактериемии у пациентов с синдромом системного воспалительного ответа. 7 Мета-анализ семнадцати исследований, оценивающих влияние пробиотиков на барьер слизистой оболочки кишечника у пациентов, перенесших операцию по поводу колоректального рака, показал, что пробиотики значительно снижают бактериальную транслокацию. Отношение Bifidobacterium к Escherichia, маркер баланса кишечной флоры, также значительно улучшилось у пациентов, принимающих пробиотики. 4
В педиатрической возрастной группе пробиотики часто используются у пациентов, у которых развивается Bifidobacterium bacteremia .Из 21 пациента, рассмотренного Weber et al, 7 были педиатрическими пациентами, и все они получали пробиотики. 10 В обзоре случая 2-летнего ребенка, у которого развился сепсис Bifidobacterium breve на фоне приема пробиотиков во время лечения острого лимфобластного лейкоза высокого риска, сделан вывод о том, что текущей литературы недостаточно, чтобы рекомендовать эмпирическое использование пробиотиков у педиатрических пациентов, получающих химиотерапия. 1
Известно, что колоректальная хирургия изменяет микробиом кишечника пациента за счет ятрогенных факторов, таких как периоперационные манипуляции, очищение кишечника, антибиотики и изменения в питании. 8 Фактически, рандомизированное контролируемое исследование обнаружило значительно меньшее количество видов Bifidobacterium и всего Lactobacillus у пациентов, перенесших механическую подготовку кишечника, по сравнению с пациентами, которые этого не сделали. 9 Испытание по изучению различий кишечного микробиома у пациентов с колоректальным раком до того, как они начали предоперационную подготовку за день до операции и после операции, снова повторно продемонстрировало значительное снижение облигатных анаэробов, включая Bifidobacterium , и обнаружило увеличение факультативных анаэробов.Пять из шести инфекций области хирургического вмешательства в этом исследовании состояли из видов, количество которых увеличилось после операции, за одним исключением — глубокая полимикробная инфекция. 6 Bifidobacterium , вид, численность которого чаще всего уменьшается после крупных операций на брюшной полости, делает источник инфекции нашего пациента еще более необычным.
Несмотря на преимущества, описанные выше, Bifidobacterium видов представляют собой редкую причину бактериемии. Изолят у этого пациента остается еще более редким: Bifidobacterium breve составляет от 13 до 19% всех случаев бактериемии Bifidobacterium . 3,10 Типичный пациент, пораженный бактериемией, вызванной видами Bifidobacterium , как указано Esaiassen et al., Является человеком крайнего возраста с ослабленным иммунитетом и нарушенным желудочно-кишечным барьером. Отчет об оценке 15 случаев сепсиса, вызванного Bifidobacterium , показал, что у 10 из этих пациентов были желудочно-кишечные заболевания, от метастатического рака толстой кишки до холецистита, из которых девять имели нарушение кишечного барьера. В этом случае пациентка попадает непосредственно в 2 из 3 этих характеристик, и источник ее бактериемии, скорее всего, связан с перемещением бактерий через ее нарушенный кишечный барьер.В обзоре 21 случая использование пробиотиков не было зарегистрировано или неизвестно у 15 взрослых пациентов с бактериемией Bifidobacterium по сравнению со 100% педиатрических пациентов. Эта пациентка снова соответствует описанной схеме, поскольку она отрицала любое недавнее использование пробиотиков или потребление активных продуктов, содержащих живые культуры, таких как йогурт или сыр. 10
Было обнаружено, что Bifidobacterium имеет низкие МИК к ванкомицину и зосину. Большинство из них также были чувствительны к клиндамицину.В целом эти бактерии были устойчивы к фторхинолонам. 3 Исследование 2005 года, в котором изучались 50 штаммов 8 видов Bifidobacterium , показало, что они чувствительны к β-лактамам, гликопептидам и эритромицину. Не было обнаружено устойчивости к пенициллину G, амоксициллину, амоксициллину / клавулановой кислоте, тикарциллину, пиперациллину, цефотаксиму и имипенему. В целом наблюдалась высокая устойчивость к метронидазолу и аминогликозидам. Следует отметить, что Bifidobacterium breve оказался более устойчивым, чем другие виды Bifidobacterium . 5 Ее клиническое улучшение можно приписать надлежащему использованию эмпирических антибиотиков и эффективному контролю источников.
Заключение
Бактерии Bifidobacterium , нормальная флора желудочно-кишечного тракта, является редкой причиной анаэробной грамположительной бактериемии. Обычный пробиотик, его часто назначают недоношенным педиатрам и онкологическим больным, которые часто подвергаются воздействию до того, как стать бактериемическим. В рассмотренных случаях бактериемии у взрослых пациентов не было отмечено, что использование пробиотиков связано с этим.Вместо этого считается, что бактериемия является результатом транслокации бактерий через нарушенный барьер желудочно-кишечного тракта у пациентов с ослабленным иммунитетом и пациентов после абдоминальной хирургии.
Извлеченные уроки
Бактериемия, вызванная редкими или неожиданными видами бактерий, всегда должна оставаться в дифференциальной диагностике пациента с сепсисом. Это особенно верно для пациентов с ослабленным иммунитетом и нарушением естественных защитных барьеров. Этот случай подчеркивает важность контроля источников и раннего использования антибиотиков широкого спектра действия.
Генно-инженерные бифидобактерии как система доставки лекарств для системной терапии пациентов с метастатическим раком молочной железы
Moulder JE, Rockwell S: Гипоксические фракции солидных опухолей: экспериментальные методы, методы анализа и обзор существующих данных. Int J Radiat Oncol Biol Phys 10: 695–712, 1984.
PubMed CAS Google Scholar
Ваупель П.В., Хоккель М: Состояние оксигенации опухолей человека: переоценка с использованием компьютерной гистографии pO2.В: Vaupel PW, Kelleher DK, Gunderoth M (eds) Tumor Oxygenation. Fischer-Verlag, New York, Stuttgart, pp219–232, 1994.
Google Scholar
Hockel M, Schlenger K, Knoop C, Vaupel PW: Оксигенация карцином шейки матки: оценка с помощью компьютерных измерений давления O2. Cancer Res 51: 6098–6102, 1991.
PubMed CAS Google Scholar
Vaupel PW: Кислородное образование солидных опухолей.В Тейхер Б.А., изд.: Устойчивость к лекарствам в онкологии. Марсель Деккер, Нью-Йорк, стр 53–85, 1993.
Google Scholar
Dachs GU, Patterson AV, Firth JD, Ratcliffe PJ, Townsend KMS, Stratford IJ, Harris AL: нацеливание экспрессии генов на гипоксические опухолевые клетки. Nat Med 3515–520, 1997.
PubMed Статья CAS Google Scholar
Мальмгрен Р.А., Фланиган К.С.: Локализация вегетативного вещества Clostridium tetani в опухолях мышей после внутривенного введения спор. Cancer Res 15: 473–478, 1955.
PubMed CAS Google Scholar
Kimura NT, Taniguchi S, Aoki K: Избирательная локализация и рост Bifidobacterium bifidum в опухолях мышей после внутривенного введения. Cancer Res 40: 2061–2068, 1980.
PubMed CAS Google Scholar
Argnani A, Leer RJ, van Luijk N, Pouwels PH: удобный и воспроизводимый метод генетической трансформации бактерий рода Bifidobacterium. Микробиология 142: 109–114, 1996.
PubMed CAS Google Scholar
Matsumura H, Takeuchi A, Kano Y: Конструирование челночного вектора Escherichia coli-Bifidobacterium longum, трансформирующего B. longum 105-A и 108-A. Biosci Biotech Biochem 61: 1211–1212, 1997.
CAS Статья Google Scholar
Ядзава К., Фудзимори М., Амано Дж., Кано Ю., Танигучи С.: Bifidobacterium longum как система доставки для генной терапии рака: селективная локализация и рост в гипоксических опухолях. Cancer Gene Ther 7: 269–274, 2000.
PubMed Статья CAS Google Scholar
Ядзава К., Фуджимори М., Накамура Т., Сасаки Т., Амано Дж., Кано И., Танигучи С.: Bifidobacterium longum как система доставки для генной терапии химически индуцированных опухолей молочной железы крыс. Лечение рака груди 66: 165–170, 2001.
PubMed Статья CAS Google Scholar
Арчер, Флорида, Орландо, штат Пенсильвания: морфология, естественное течение и паттерны ферментов в опухолях молочной железы у крыс, вызванные 7,12-диметилбензантрансеном. Cancer Res 28: 217–224, 1968.
PubMed CAS Google Scholar
Шимкин М.Б., Грюнштейн М., Меранце Д.Р., Акуфф М., Тэтчер Д.: Влияние схемы приема и дозы 7,12-диметилбензантрансена на индукцию и рост карцином молочной железы у крыс Sprague-Dawley. Cancer Res 29: 503–505, 1969.
PubMed CAS Google Scholar
Takeuchi A, Matsumura H, Kano Y: Клонирование и экспрессия в escherichia coli гена hup, кодирующего гистоноподобный белок HU Bifidobacterium longum. Biosci Biotechnol Biochem 66: 598–603, 2002.
PubMed Статья CAS Google Scholar
Накамура Т., Сасаки Т., Фуджимори М., Ядзава К., Кано Ю., Амано Дж., Танигучи С. Экспрессия клонированного гена цитозиндезаминазы Bifidobacterium longum и применение для ферментативной / пролекарственной терапии гипоксических солидных опухолей. Biosci Biotech Biochem 66: 2362–2366, 2002.
Статья CAS Google Scholar
Minton NP, Mauchline ML, Lemmon MJ, Brehm JK, Fox M, Michael NP, Giaccia A, Brown JM: химиотерапевтическое нацеливание на опухоли с использованием клостридиальных спор. FEMS Microbiol Rev 17: 357–364, 1995.
PubMed Статья CAS Google Scholar
Fox ME, Lemmon MJ, Mauchline ML, Davis TO, Giaccia AJ, Minton NP, Brown JM: Анаэробные бактерии как система доставки для генной терапии рака: активация 5-фторцитозина in vitro с помощью генно-инженерных клостридий. Gene Ther 3: 173–178, 1996.
PubMed CAS Google Scholar
Pawelek JM, Low KB, Bermudes D: Сальмонелла, нацеленная на опухоль, как новый вектор противорака. Cancer Res 57: 4537–4544, 1997.
PubMed CAS Google Scholar
Theys J, Landuyt W., Nuyts S, Van Mellaert L, van Oosterom A, Lambin P, Anne J: Специфическое нацеливание цитозиндезаминазы на солидные опухоли с помощью сконструированного Clostridium acetobutylicum. Cancer Gene Ther 8: 294–297, 2001.
PubMed Статья CAS Google Scholar
Mei S, Theys J, Landuyt W., Anne J, Lambin P: Оптимизация доставки генов, нацеленных на опухоль, с помощью сконструированной аттенуированной Salmonella Typhimurium. Anticancer Res 22: 3261–3266, 2002.
PubMed CAS Google Scholar
Fox ME, Lemmon MJ, Mauchline ML, Davis TO, Giaccia AJ, Minton NP, Brown JM: Анаэробные бактерии как система доставки для генной терапии рака: активация 5-фторцитозина in vitro с помощью генно-инженерных клостридий.
