Перекись водорода инструкция по применению: показания, противопоказания, побочное действие – описание Hydrogen peroxide р-р д/местн. и наружн. прим. 3%: фл. 40 мл или 100 мл 1, 50 или 80 шт.; фл. 500 мл 12 шт.; фл. 1000 мл 8 шт. (33316)
Раствор для местного и наружного применения прозрачный, бесцветный, без запаха.
| 100 мл | |
| водорода пероксид* | 3 г |
* в виде субстанции-раствора перекиси водорода 3%.
Вспомогательные вещества: натрия бензоат — 0.05 г, вода очищенная — до 100 мл.
40 мл — флаконы стеклянные (1) — пачки картонные.
40 мл — флаконы стеклянные (1) — пленка полиэтиленовая.
40 мл — флаконы-капельницы стеклянные (1) — пачки картонные.
40 мл — флаконы-капельницы стеклянные (1) — пленка полиэтиленовая.
40 мл — флаконы полиэтиленовые (1) — пачки картонные.
40 мл — флаконы полиэтиленовые (1) — пленка полиэтиленовая.
100 мл — флаконы стеклянные (1) — пачки картонные.
100 мл — флаконы стеклянные (1) — пленка полиэтиленовая.
100 мл — флаконы-капельницы стеклянные (1) — пачки картонные.
100 мл — флаконы-капельницы стеклянные (1) — пленка полиэтиленовая.
100 мл — флаконы полиэтиленовые (1) — пачки картонные.
100 мл — флаконы полиэтиленовые (1) — пленка полиэтиленовая.
40 мл — флаконы стеклянные (80) — коробки картонные (для стационаров).
40 мл — флаконы стеклянные (80) — пленка полиэтиленовая (для стационаров)
40 мл — флаконы-капельницы стеклянные (80) — коробки картонные (для стационаров).
40 мл — флаконы-капельницы стеклянные (80) — пленка полиэтиленовая (для стационаров).
40 мл — флаконы полиэтиленовые (80) — коробки картонные (для стационаров).
40 мл — флаконы полиэтиленовые (80) — пленка полиэтиленовая (для стационаров).
100 мл — флаконы стеклянные (50) — коробки картонные (для стационаров).
100 мл — флаконы стеклянные (50) — пленка полиэтиленовая (для стационаров).
100 мл — флаконы-капельницы стеклянные (50) — пачки картонные (для стационаров).
100 мл — флаконы-капельницы стеклянные (50) — пленка полиэтиленовая (для стационаров).
100 мл — флаконы полиэтиленовые (50) — коробки картонные (для стационаров).
100 мл — флаконы полиэтиленовые (50) — пленка полиэтиленовая (для стационаров).
500 мл — флаконы полиэтиленовые (12) — коробки картонные (для стационаров).
500 мл — флаконы полиэтиленовые (12) — пленка полиэтиленовая (для стационаров).
1000 мл — флаконы полиэтиленовые (8) — коробки картонные (для стационаров).
1000 мл — флаконы полиэтиленовые (8) — пленка полиэтиленовая (для стационаров).
Перекись водорода инструкция по применению, цена в аптеках Украины, аналоги, состав, показания | Hydrogen peroxide
Перекись водорода относится к категории пероксосоединений — нестабильных соединений, в которых атомы кислорода соединены между собой одной двухэлектронной связью. Перекись водорода разлагается под действием фермента каталазы, который содержится в крови и тканях человеческого организма. Этот процесс является экзотермическим, то есть происходит с выделением тепла, а также с образованием активного кислорода (Фармацевтична енциклопедія).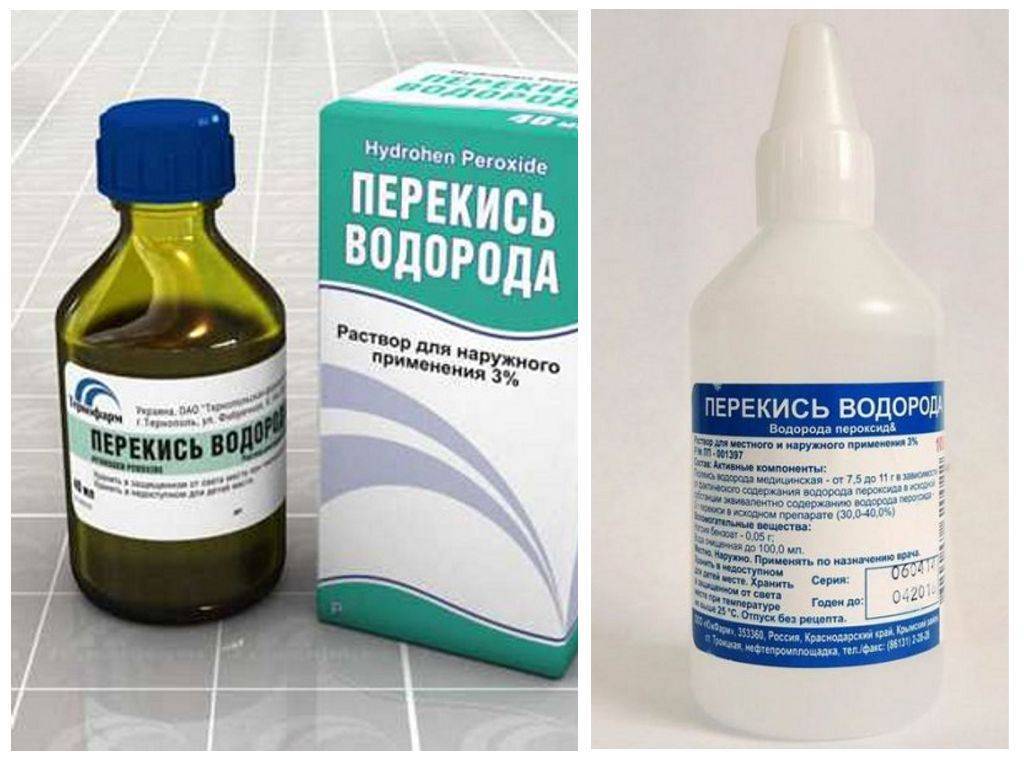 При этом отмечается окислительный эффект — элементарный кислород окисляет белки, компоненты крови и гноя, создает неблагоприятные условия для существования микроорганизмов, особенно анаэробных и гнилостных. Перекись водорода не только оказывает дезинфицирующее действие за счет элементарного кислорода, но и механически очищает раневую поверхность от загрязнений благодаря интенсивному пенообразованию. Вспенивание способствует тромбообразованию, так что перекись водорода позволяет остановить капиллярное кровотечение. Кроме того, перекись водорода оказывает дезодорирующий и обесцвечивающий эффекты, которые также используются в различных сферах медицины (Фармацевтична енциклопедія). Одним из преимуществ перекиси водорода в клинической практике является то, что она разлагается до воды и активного кислорода и не оказывает токсического действия (Амонов Ш.Ш., 2011).
При этом отмечается окислительный эффект — элементарный кислород окисляет белки, компоненты крови и гноя, создает неблагоприятные условия для существования микроорганизмов, особенно анаэробных и гнилостных. Перекись водорода не только оказывает дезинфицирующее действие за счет элементарного кислорода, но и механически очищает раневую поверхность от загрязнений благодаря интенсивному пенообразованию. Вспенивание способствует тромбообразованию, так что перекись водорода позволяет остановить капиллярное кровотечение. Кроме того, перекись водорода оказывает дезодорирующий и обесцвечивающий эффекты, которые также используются в различных сферах медицины (Фармацевтична енциклопедія). Одним из преимуществ перекиси водорода в клинической практике является то, что она разлагается до воды и активного кислорода и не оказывает токсического действия (Амонов Ш.Ш., 2011).
Перекись водорода: опыт практического применения
Промывание гнойных ран (например флегмоны стопы) 3% р-ром перекиси водорода является традиционным способом ведения этой патологии. Это и дает основания оптимизировать методики обработки раны, в частности сочетание р-ра перекиси водорода с наносеребром для улучшения результатов лечения (Акрамов Э.Х., 2020). Кроме того, при промывании полости абсцесса можно последовательно применять 3% р-р перекиси водорода и 0,05% р-р хлоргексидина (Денисенко В.Л., 2008) или 0,01% р-р мирамистина (Винник Ю.С., 2015).
Это и дает основания оптимизировать методики обработки раны, в частности сочетание р-ра перекиси водорода с наносеребром для улучшения результатов лечения (Акрамов Э.Х., 2020). Кроме того, при промывании полости абсцесса можно последовательно применять 3% р-р перекиси водорода и 0,05% р-р хлоргексидина (Денисенко В.Л., 2008) или 0,01% р-р мирамистина (Винник Ю.С., 2015).
Особым случаем в хирургической практике является обработка ран при столбняке — р-р перекиси водорода создает неблагоприятные условия для анаэробного возбудителя C. difficile. При этом промывание раны сочетают с регулярным удалением нежизнеспособных тканей, обеспечением доступа кислорода к зоне инфицирования и специфической антибиотикотерапией (Петлах В.И., 2017).
Р-р перекиси водорода широко применяется в стоматологической практике — для местного лечения острого герпетического стоматита (Рахмонова Ф.М., 2019). Описана методика антисептической обработки зубов, препарированных под металлокерамические протезы. Обработка при этом включает поочередное нанесение 3% р-ра перекиси водорода и 0,0,5% р-ра хлоргексидина биглюконата (Ирза О.Л., 2019). Кроме того, р-р перекиси водорода в концентрации 24–40% широко применяется в различных методиках отбеливания зубов (Ганичева О.В., 2018).
Обработка при этом включает поочередное нанесение 3% р-ра перекиси водорода и 0,0,5% р-ра хлоргексидина биглюконата (Ирза О.Л., 2019). Кроме того, р-р перекиси водорода в концентрации 24–40% широко применяется в различных методиках отбеливания зубов (Ганичева О.В., 2018).
Возможно также применение перекиси водорода в отоларингологии. 3% р-р применяют для размягчения серной пробки наружного слухового прохода. После ее размягчения обязательно промывают слуховой проход теплой водой (Бакитова Р.Б., 2012).
Разработан способ остановки гипотонического кровотечения с применением перекиси водорода: 3% р-р вводится в полость матки под контролем УЗИ, при этом в качестве носителя используется силиконовый гель. Денатурирующий эффект препарата способствует физическому свертыванию крови в течение нескольких секунд даже на фоне системной гипокоагуляции. Кроме того, вспененная кровь, перемешанная с силиконовым гелем, быстро увеличивается в объеме и обеспечивает «тампонирующий эффект» за счет повышения внутриполостного давления и сдавливания маточных сосудов (Ураков А. Л., 2007).
Л., 2007).
Описан опыт применения перекиси водорода для склерозирующей пункционной терапии кист яичника. При этом под контролем УЗИ выполняются пункция кисты, эвакуация содержимого и промывание полости методом многократного введения и эвакуации 3% р-ра перекиси водорода. Такой метод зарекомендовал свою эффективность — выписывать пациенток из стационара можно уже на 2-е сутки после манипуляции и, по данным наблюдения в течение 1 года, не отмечается рецидивов кистозных образований (Палакян Л.П., 2008).
Описана методика эндоскопического инфильтрационного гемостаза при желудочных кровотечениях. При наличии гастродуоденальной язвы или дефекта Дьелафуа проводится обкалывание зоны кровотечения 1% р-ром перекиси водорода в сочетании с 5% р-ром γ-аминокапроновой кислоты (Короткевич А.Г., 2012). Такая техника обеспечивает тромбообразование в мелких сосудах и препятствует преждевременному тромболизису. Орошение зоны кровотечения 3% р-ром перекиси водорода также является методикой эндоскопического гемостаза. Эта методика считается наиболее технически простой и быстро выполняемой (Короткевич А.Г., 2004).
Эта методика считается наиболее технически простой и быстро выполняемой (Короткевич А.Г., 2004).
Перекись водорода (в форме 33% р-ра) применяют для обработки эхинококковых кист. После эвакуации содержимого кисты проводится ее деэпителизация и деструкция р-ром перекиси водорода (Амонов Ш.Ш., 2011).
В эксперименте на крысах доказано, что 6% р-р перекиси водорода можно применять для химического плевродеза — химического спаивания париетального и висцерального листков плевры. Такой метод может применяться в лечении пневмоторакса — после обработки перекисью водорода уже на 7–10-е сутки отмечаются четко выраженные спайки между листками плевры, которые через месяц прогрессируют до плоскостных сращений (Изюмов М.С., 2018).
Перекись водорода: применение в диагностических мероприятиях
3% р-р перекиси водорода применяется для оценки эффективности гемостаза при вмешательствах на почке. Для этого 3 мл мочи из нефростомы (непосредственно из оперированной почки) смешивается с 0,5 мл р-ра перекиси водорода.
Перекись водорода применяется в методике иммуногистохимического исследования — ее 3% р-р наносят на срез биоптата для ингибирования эндогенной пероксидазы опухолевых клеток, после чего гистологический препарат окрашивается специфическим хромогеном (Раскин Г.А., 2014).
Перекись водорода: заключение
Р-р перекиси водорода широко применяется в практической медицине, особенно в хирургических специальностях. Р-ры различных концентраций применяются для решения различных клинических задач, а также используются в некоторых диагностических методиках.
употребление перекиси водорода внутрь может привести к развитию рака
Пить или не пить перекись водорода?
Популярнейшую среди населения методику лечения перекисью водорода, которую активно пропагандирует Иван Неумывакин, прокомментировал врач-кардиолог.

Для избавления от множества заболеваний и улучшения состояние здоровья автор популярной методики советует разводить трехпроцентный раствор перекиси водорода в воде и принимать три раза в день за полчаса до еды. Оздоравливать организм с помощью дешевого аптечного средства советуют даже детям, начиная с пятилетнего возраста.
По мнению Германа Гандельмана пользы от этого не будет. Более того, соведущий программы «Жить здорово» категорически не советует пользоваться этим средством не по инструкции.
На вопрос, можно ли принимать раствор перекиси водорода внутрь, он ответил: «Нет! Запомните навсегда: небольшое количество перекиси водорода образуется у нас в организме. Она сразу расщепляется на молекулу воды и свободный радикал, который повреждает клетки. Наш организм выработал систему, которая защищает его от перекиси водорода. Но она работает для небольшого количества, когда бы вбухаете внутрь вот такое (большое — прим.
В завершении Герман Гандельман воскликнул: «Если организм ее нейтрализует, какого черта ее пить!»
Кардиолога поддерживают и другие известные популяризаторы медицины, например, доктор Мясников, который предупреждает, что пить перекись водорода нельзя категорически.
Перекись водорода
Состав:
действующее вещество: водорода пероксид;
вспомогательные вещества: натрия бензоат (Е 211), вода очищенная.
Врачебная форма. Раствор для наружного применения.
Основные физико-химические свойства: прозрачная бесцветная жидкость.
Фармакологическая группа. Антисептические и дезинфицирующие средства. Код АТХ D08А Х01.
Фармакологические свойства. Фармакологические. При контакте раствора перекиси водорода с поврежденной кожей и слизистыми оболочками высвобождается активный кислород, который способствует очищению раневой поверхности и инактивации органических веществ (протеин, кровь, гной). При применении препарата происходит лишь временное уменьшение количества микроорганизмов. Препарат обладает кровоостанавливающим эффектом.
Фармакокинетика. Не изучалась.
Клинические характеристики.
Показания. Лекарственное средство применяют для остановки капиллярного кровотечения при поверхностном повреждении тканей, носовых кровотечениях, для обработки слизистой оболочки при стоматитах, пародонтитах, ангинах, гинекологических заболеваниях, а также при гнойных ранах.
Противопоказания. Повышенная чувствительность к препарату.
Повышенная чувствительность к препарату.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий. Взаимодействие пока неизвестно.
Особенности применения. Применение раствора на повязку обеспечивает безболезненное снятие ее с раны. Большое количество пены, образующейся способствует механическому очищению раны от гноя и тканевого детрита. Препарат следует с осторожностью применять для обработки глубоких ран и орошения полостей, учитывая возможность эмболии.
Препарат нестабильный в щелочной среде, в присутствии металлов, сложных радикалов некоторых оксидантов, а также в освещенном и теплом месте. Следует избегать попадания раствора в глаза.
Не следует нарушать правила применения лекарственного средства — это может навредить здоровью.
Применение в период беременности или кормления грудью. Применяют.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами. Не влияет.
Не влияет.
Способ применения и дозы. Раствор перекиси водорода наносят на поврежденный участок кожи для дезинфекции ран per se (т.е. без разведения). Для полоскания растворяют 1 столовую ложку в 1 стакане воды; для аппликаций, обработки раневых поверхностей, остановки кровотечения (капиллярной) пораженные участки обрабатывают тампоном, пропитанным раствором перекиси водорода. Продолжительность лечения зависит от достигнутого эффекта.
Дети. Применяют.
Передозировки. Не наблюдались.
Побочные реакции. Возможно ощущение жжения в момент обработки раны. В некоторых случаях при индивидуальной чувствительности к компонентам препарата возможно возникновение местных аллергических реакций. При длительном применении для обработки слизистой оболочки рта возможна гипертрофия сосочков языка.
В случае появления любых нежелательных явлений необходимо обратиться к врачу.
Срок годности. 2 года. Препарат нельзя применять после окончания срока годности, указанного на упаковке.
2 года. Препарат нельзя применять после окончания срока годности, указанного на упаковке.
Условия хранения. Хранить в оригинальной упаковке при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Упаковка. По 40 мл во флаконе без пачки или в пачке, или 100 мл во флаконе без пачки.
Категория отпуска. Без рецепта.
Производитель / заявитель. ООО «Тернофарм».
Местонахождение производителя и адрес места осуществления его деятельности / местонахождение заявителя. ООО «Тернофарм», Украина, 46010, г.. Тернополь, ул. Фабричная, 4
Дата последнего пересмотра. 30.01.19
Перекись водорода
В связи с пандемией коронавируса по всему миру, все больше людей запасается дезинфицирующими средствами.
Однако в условиях их дефицита, люди ищут альтернативу традиционным чистящим средствам. Одним из таких средств является перекись водорода, которая на протяжении многих поколений остается средством
первой помощи при ранах и порезах.
Одним из таких средств является перекись водорода, которая на протяжении многих поколений остается средством
первой помощи при ранах и порезах.
Дезинфекция с помощью перекиси водорода
По данным Центра по контролю и профилактике заболеваний перекись водорода убивает грибки, бактерии, вирусы и споры
плесени.
Оно является стабильным и эффективным антисептическим средством против вирусов при применении на твердых, непористых
поверхностях.
Перекись водорода (h3O2) — это мощное дезинфицирующее средство, которое убивает бактерии, такие как
стафилококки, и вирусы, включая h2N1, SARS и коронавирусы.
Это связано с тем, что перекись водорода в полностью концентрированной форме является слишком сильным средством для
домашнего применения и фактически используется в качестве ракетного топлива и отбеливающего и коррозионного агента
на производстве.
Перекись водорода (h3O2) является высоко реактивным веществом и действует на микробы путем окисления. Этот процесс происходит, когда реактивные атомы кислорода взаимодействуют с электронами других клеток, что приводит к разрушению стенок клеток, образующих бактерии.
Чтобы получить раствор 6% нужно, разбавить перекись с водой в пропорции 1/6. Чтобы получить 500 мл шестипроцентного раствора нужно, обязательно надеть перчатки, взять тару 500мл, воронку. Берем 75мл 37% перекиси наливаем в тару и добавляем воды 387 мл чтоб общий объём получился 462мл. (75мл перекиси умножаем на 5.17=387.75 мл воды)следовательно 387.75+75= 462,75мл шести процентного раствора. Далее переливаем его в пульверизатор и можем начинать проводить дезинфекцию
Применение перекиси водорода для дезинфекции
Когда дело касается универсальных нетоксичных чистящих средств, мало что может сравниться с 3% раствором перекиси
водорода. Ее можно использовать для дезинфекции различных поверхностей.
Ее можно использовать для дезинфекции различных поверхностей.
Кухонная раковина
Намочите поверхность раковины. Затем очистите раковину пищевой содой с помощью губки. После того, как вы протерли всю поверхность, нанесите на нее 3% раствор перекиси водорода и оставьте на 5 минут, а потом промойте поверхность.
Столешница и разделочные доски
По мнению специалистов протирание столешницы или разделочных досок 3% раствором перекиси водорода помогает убить кишечную палочку и сальмонеллу на твердой поверхности, если оставить ее на 10 минут при комнатной температуре.
Мусорное ведро
Промыв мусорное ведро мылом с водой, распылите в контейнере раствор из перекиси водорода и воды в соотношении
1:1. Оставьте ведро высыхать на Солнце в течение нескольких часов. Перекись водорода помогает не только очистить
поверхность, но и убивает микробы в мусорном ведре.
Холодильник и посудомоечная машинка
Благодаря тому, что перекись водорода является нетоксичным средством, ее можно использовать для очистки мест, где хранятся продукты и посуда. Распылите ее с внешней и внутренней стороны холодильника и посудомоечной машины, оставьте раствор на несколько минут и затем протрите чистой тряпочкой.
Губки для мытья посуды
Замочите губки для мытья посуды на 10 минут в смеси из раствора перекиси водорода и воды в соотношении 1:1 в пустой миске. Затем тщательно промойте губки.
Туалет
Перекись водорода эффективна в борьбе с микроорганизмами, включая бактерии, грибки, вирусы и плесень, благодаря
чему она может стать прекрасным средством для очищения туалета. Для очищения туалета добавьте 1/2 чашки 3%
раствора перекиси водорода в чашу унитаза, чтобы убить микробы и придать блеск поверхности унитаза.
Оставьте раствор на 20 минут для большей эффективности.
Зеркала и стеклянные поверхности
Распылите раствор из перекиси водорода и воды в соотношении 1:1 на стеклянную поверхность, а затем протрите ее бумажными полотенцами, тряпочкой без ворса или газетой, чтобы избежать разводов.
Душевая кабинка
Плесень легко образуется во влажной среде душевой кабинки. Чтобы ее убить, не вдыхая токсичные пары отбеливателя, распылите неразбавленный 3% раствор перекиси водорода и оставьте на 30 минут. Ополосните поверхность.
Ручки дверей
Протрите или распылите 3% раствор перекиси водорода на ручки дверей и оставьте на 5 минут. Затем вытрите поверхность.
Полы
Для очищения и дезинфекции полов, вам нужно сделать следующее:
Смешайте в равных частях воду и перекись водорода в ведре. Протрите полы как обычно и дайте им высохнуть.
Стоит помнить об отбеливающих свойствах перекиси водорода, поэтому лучше предварительно проверить ее действие на
цветных и деревянных полах, прежде чем применять.
Протрите полы как обычно и дайте им высохнуть.
Стоит помнить об отбеливающих свойствах перекиси водорода, поэтому лучше предварительно проверить ее действие на
цветных и деревянных полах, прежде чем применять.
Дезинфицирующее замачивание
Кроме протирания твердых поверхностей, вы можете сделать средство для замачивания. Просто наполните емкость перекисью водорода и используйте для замачивания дестких игрушек, зубных щеток, ретейнеров для зубов на 10-20 минут. Дайте им высохнуть и используйте как обычно
Хранение перекиси водорода
Для того, чтобы перекись водорода служила вам эффективным дезинфектантом, важно правильно ее хранить.
Перекись водорода разрушается под воздействием света, поэтому ее продают в темных пластиковых бутылках.
Храните бутылочку с перекисью водорода в прохладном, сухом месте, чтобы она оставалась стабильной в течение
длительного времени.
Меры предосторожности
Перекись водорода обладает множеством полезных чистящих и дезинфицирующих свойств сама по себе. Однако нужно быть осторожным при смешивании ее с другими веществами. Так, например, нельзя смешивать в одной емкости перекись водорода с отбеливателем, а также перекись водорода с белым уксусом из-за того, что такие смеси могут вызвать нежелательные последствия. Однако вы можете сначала протереть поверхность перекисью водорода, а затем уксусом (не смешивая!), в качестве мощного средства для борьбы с бактериями и вирусами на твердых поверхностях.
Вернуться в каталог
Заказ продукции
Перекись водорода 60%, 50% — Оптовая Компания промышленной химии в Ростове-на-Дону
Химическая формула:h3O2
Международное название:HYDROGEN PEROXIDE
CAS No:7722-84-1
Квалификация:Имп.
Внешний вид:прозрачная бесцветная жидкость
Условия хранения:в сухом, хорошо проветриваемом помещении
Синонимы: Пероксид водорода, гидропероксид, водорода диоксид, пергидроль
Мы предлагаем Перекись водорода 60% по выгодным ценам с доставкой по всей России.
| Спецификация | |
|---|---|
| Массовая доля пероксида водорода, не менее | 60% |
| Стабильность, не менее | 98% |
| Осадок после выпаривания, не более | 0,05% |
| Массовая доля свободной кислоты, не более | 0,03% |
| Ph (20 C) | не более 2,0 |
Получение
• Пероксид водорода получают в промышленности по реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
(Ch4)2СН(ОН) + O2 → Ch4C(O)Ch4 + h3O2
Ценным побочным продуктом этой реакции является ацетон.
• В лабораторных условиях для получения пероксида водорода используют реакцию
BaO2 + h3SO4 → h3O2 + BaSO4
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам перекись водорода 50% (пероксид водорода), h3O2 нашла широкое применение в быту и в промышленности, где используется, например:
• как отбеливатель на текстильном производстве и при изготовлении бумаги.
• в качестве окислителя при производстве топлива,
• в аналитической химии, в медицине, растворы пероксида водорода применяются как антисептическое средство,
• в качестве пенообразователя при производстве пористых материалов,
• в производстве дезинфицирующих и отбеливающих средств,
• в сельском хозяйстве в растениеводстве для обработки семян, силоса, почвы, в животноводстве для применения в инкубаторах, стерилизации животных;
• в пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки и др.
Подробнее на Wikipedia
Перекись для бассейна. Мнение эксперта.
Популярные форумы пестрят сообщениями о том, как легко содержать бассейн чистым, используя перекись. Если верить «диванным экспертам», то это экономичный, простой и полезный способ дезинфекции бассейна. Без запаха хлора. Достаточно купить пару канистр технической пергидроли и подливать её в бассейн по мере необходимости. Но почему же общественные бассейны всегда обрабатываются гипохлоритом натрия? Почему в современном ГОСТ Р 53491.1-2009 «Бассейны. Подготовка воды.» такой метод обеззараживания не признан разрешённым? Давайте разбираться. При этом опираться будем не только на российские исследования и законы, а задействуем и мировой опыт.
Что такое окисление и дезинфекция?
Подготовка воды бассейна состоит из двух процессов: окисления и дезинфекции.
Окисление — это процесс, в котором окислитель реагирует с загрязнениями в бассейне. Загрязнения — пот, носовые выделения, кожное сало, моча, косметика и др., что попадает в воду с купающихся. Они ухудшают качество воды и создают благоприятные условия для роста микроорганизмов.
Дезинфекция — это процесс, при котором разрушаются микроорганизмы (в первую очередь, болезнетворные бактерии, вирусы, простейшие).
Существует много средств, обладающих дезинфекционными свойствами. Но все они отличаются по скорости, с которой они разрушают микроорганизмы при конкретной концентрации действующего вещества. Какой же уровень дезинфекции требуется в бассейне? На этот вопрос отвечают санэпидем стандарты.
Дезинфицирующие средства отличаются по скорости разрушения микроорганизмов. Одни убивают их за секунды, другие за минуты, третьим требуются часы (а иногда действующее вещество настолько слабое, что разрушает микроорганизмы медленнее, чем они растут).
Стандарты определяют, за какое время рекомендуемая концентрация действующего вещества должна уничтожить микроорганизмы в условиях обычного бассейна. То есть они устанавливают:
- Что такое «уничтожить». Обычно требуется 4-log (99.99%) сокращение, то есть должно остаться не более 0.01% от изначальных микроорганизмов.
- Время, за которое будут уничтожены эти микроорганизмы.
Традиционно в исследованиях берется кишечная палочка (E. coli), как микроорганизм для экспериментов. Есть исследования и с другими бактериями / вирусами / простейшими, но я буду использовать палочку, так как о ней есть больше всего данных.
В США Служба по охране окружающей среды (EPA) постановила, что для признания средства подходящим для дезинфекции бассейнов, оно должно обеспечить 6-log сокращение (остается не более 0.0001%) кишечной палочки в воде бассейна за 30 секунд (тест EPA DIS/TSS-12).
В Австралии по стандарту APVMA нужно 4-log сокращение (остается не более 0.01%) кишечной палочки за 30 секунд. Ниже приложил стандарт в PDF.
Но мы считаем, что в бытовых условиях допустимо 2-log сокращение (остается не более 1% микроорганизмов) за 2 минуты, так как пользование обычно происходит одной семьёй и их близкими.
Давайте посмотрим, как в исследованиях проявляется дезинфекционная способность перекиси водорода, а для сравнения возьмем самое известное дезинфекционное средство — хлор.
Перекись водорода против хлора.
Так как же проявляют себя перекись и хлор в бассейне? Для простоты возьмем как критерий самые «легкие» условия, инактивацию 99% бактерий за 2 мин. На основании научных публикаций я свел данные по перекиси и хлору на рисунке ниже.
Время — Средство и его концентрация — Остаточное содержание E. coli
00:30 — Хлор 0.5 ppm — <0.01% E. coli (1,2)
01:00 — Хлор 0.25 ppm — <0.01% E. coli (1)
01:00 — Хлор 0.1 ppm — <0.1% E. coli (расчетные данные) (3)
…
30:00 — Перекись водорода 150 ppm — 74% E. coli (4,5)
60:00 — Перекись водорода 30 ppm — 23% E. coli (6)
Источники:
(1) «Chlorine Inactivation of Escherichia coli O157:H7 in Water», ссылка
(2) «CDC: Effect of Chlorination on Inactivating Selected Pathogen», ссылка
(3) TroubleFreePool: «converting my ecosmarte system to chlorine», ссылка
(4) «Comparative assessment of different biocides in swimming pool water», ссылка
(5) TroubleFreePool: «New APVMA Guidelines For Pool & Spa Sanitisers July 1st 2014», ссылка
(6) «The interaction of silver ions and hydrogen peroxide in the inactivation of E. coli», ссылка
По-моему, данные говорят сами за себя.
Хлор в концентрации 0.5 ppm успешно уничтожил E. coli в воде за 30 сек, в концентрации 0.25 ppm и 0.1 ppm. Он сделал это за минуту! Перекись водорода, в разных концентрациях, не смогла даже сократить кол-во в 10 раз (1-log сокращение). Более того, по ссылке 5 (вверху) прокомментированы результаты перекиси 150 ppm за 30 минут: «этого [дезинфицирующей способности] даже недостаточно для предотвращения неконтролируемого роста бактерий в идеальных условиях для этого роста». Не то что неспособна уничтожить — неспособна предотвратить *неконтролируемый* рост!
А теперь обратимся к СанПиН 2.1.4.1074-01 «Питьевая вода.» (а вода в бассейне имеет требования по содержанию элементов как питьевая, ведь при купании происходит непроизвольное проглатывание воды в малых количествах).
Как видите, разрешённые содержания перекиси не позволяют её рассматривать как эффективное средство. А передозировка запрещена, так как это вещество отнесено по показателю вредности к санитарно-токсикологическому. При этом класс опасности выше чем у гипохлорита.
Итоги
Подведу итог следующей выдержкой. В Министерстве здравоохранения США есть орган, Центр контроля и профилактики заболеваний (вроде нашей санэпидемслужбы). Он регулярно публикует и обновляет свод правил по безопасной организации и эксплуатации водных заведений. Вот что они пишут в разделе «Дезинфекция» по поводу перекиси водорода:
Перекись водорода не зарегистрирована в Службе по охране окружающей среды США (EPA) как дезинфицирующее средство для воды бассейнов. Поскольку оно не зарегистрировано, использовать его для дезинфекции воды бассейнов запрещается. Перекись водорода зарегистрирована службой (EPA) как дезинфицирующее средство для твердых поверхностей, а также для некоторых других целей.
При использовании как дезинфекционное средство для обработки поверхности, обычно используется 3% раствор перекиси водорода. При использовании в бассейнах, перекись водорода используется в концентрациях 27-100 ppm (мг/л), что в 1111 и 3000 раз, соответственно, более разведенный раствор, чем то, что используется для поверхностей. Боргман-Штразен (см. ссылку 4 выше) изучил противомикробные свойства перекиси водорода в концентрациях 80 ppm и 150 ppm в симулированных условиях бассейна. Независимо от того, использовалась только лишь перекись водорода в концентрации 150 ppm или вместе с 24 ppb нитратом серебра, она имела незначительное влияние на Pseudomonas aeruginosa, E. coli. Staphylococcus aureus, Legionella pneumophila или Candida albicans даже за 30 минут. В том же эксперименте, гипохлорит натрия, используемый в качестве контрольного средства, показал типичные скорости уничтожения, широко опубликованные в литературе. Боргман-Штразен заключил, что перекись водорода, с добавлением ионов серебра или без оных, «не является реальной альтернативой хлорной дезинфекции воды плавательных бассейнов с точки зрения микробиологии».
Ссылка на источник (стр. 240) : https://www.cdc.gov/mahc/pdf/2016-mahc-annex-final
По материалам Forumhouse
Перекись водорода
Перекись водородаПерекись водорода (H 2 O 2 ) — бесцветная жидкость, во многих отношениях напоминающая воду. Его физические свойства очень похожи на свойства воды, за исключением того, что она на 40% плотнее. Однако основное различие между перекисью водорода и водой заключается в ее химическом поведении. Одинарная связь между двумя атомами кислорода является слабой, так что H 2 O 2 легко фрагментируется либо на H и HO 2 , либо на два OH.В любом случае образующиеся частицы являются свободными радикалами, что означает, что они очень реакционноспособны, и это делает H 2 O 2 очень мощным окислителем. По этой причине он использовался в ракетных двигателях, когда он используется для окисления гидразинового топлива с выделением горячих газов (пара и кислорода), которые продвигают ракету вперед.
Антисептический лосьон
Окислительная способность H 2 O 2 на протяжении десятилетий также использовалась в домашних условиях для лечения мелких порезов и царапин.Его окислительные свойства эффективны в подавлении роста и уничтожении микробов. Что делает перекись водорода уникальной, так это вспенивание, которое происходит всякий раз, когда ее помещают на разрез. Некоторые люди раньше полагали, что это пенообразование указывает на присутствие инфекции, и что H 2 O 2 пенится, поскольку он должен действовать, уничтожая болезнь. На самом деле перекись водорода пенится при каждом контакте с кровью, потому что фермент в крови катализирует разложение H 2 O 2 до воды и газообразного кислорода.Но преимущество вспенивающего действия заключается в том, что перекись водорода действует как чистящее средство, вынося любую въевшуюся грязь на поверхность. H 2 O 2 присутствует в меде в следовых количествах, поэтому до появления современных методов химического приготовления мед использовался для перевязки ран.
H 2 O 2 является настолько сильным окислителем, что продается в концентрации всего 3% в воде. Это делает его более безопасным в обращении, но имеет тот недостаток, что он медленно реагирует с водой и разлагается.Это разложение усиливается, когда молекулы находятся в присутствии света, поэтому H 2 O 2 обычно продается и хранится в коричневых бутылках.
Пероксидный блондин
Другая роль H 2 O 2 — это отбеливающий агент. Окислительная способность H 2 O 2 позволяет ему напрямую реагировать с двойными связями в больших органических молекулах, образуя органические пероксиды. Поскольку двойные связи часто являются причиной того, что молекулы поглощают свет и, следовательно, придают молекуле ее цвет, их удаление разрушает пигменты и, таким образом, удаляет цвет.H 2 O 2 используется таким образом для отбеливания древесной массы для изготовления белой бумаги и меланина в волосах. Некоторые из самых известных голливудских кинозвезд, такие как Мэрилин Монро и Джин Харлоу, были «перекисными блондинками» и, возможно, обязаны своей известностью молекуле H 2 O 2 . Одно из преимуществ перекиси водорода перед некоторыми другими отбеливающими агентами, такими как газообразный хлор, состоит в том, что продукты разложения, вода и кислород, не являются вредными.
Перекись водорода также играет менее полезную роль в современной жизни как одна из причин фотохимического смога.Воздействие солнечного света разлагает его и образует свободные радикалы, которые затем атакуют несгоревшие молекулы углеводородного топлива и превращают их в молекулы, раздражающие нос и глаза.
Артикул:
- Основы химии , Брэди и Холум, (Уайли, Нью-Йорк, 1988)
- Молекулы , P.W. Аткинс (W.H. Freeman and Co, Нью-Йорк, 1987).
Перекись водорода — структура, применение и свойства перекиси водорода
Перекись водорода — очень нестабильное химическое соединение.Две молекулы водорода соединяются с двумя молекулами кислорода с образованием перекиси водорода. Следовательно, его химическая формула H 2 O 2 . Перекись водорода — это бледно-голубая прозрачная жидкость, немного более вязкая, чем вода в чистом виде. Это простейший пероксид (поскольку это соединение с одинарной связью кислород-кислород). Пероксид водорода обычно используется в качестве окислителя, отбеливающего агента и антисептика. Концентрированная перекись водорода, также известная как «перекись высокого давления», представляет собой реактивную форму кислорода и использовалась в качестве топлива в ракетных двигателях.Поскольку это соединение нестабильно, оно медленно разлагается в присутствии света. Пероксид водорода обычно хранится со стабилизатором в слабокислом растворе, поскольку он нестабилен. Его можно найти в биологических системах, в том числе в организме человека. Пероксидазы — это ферменты, которые используют или разлагают перекись водорода.
ИСТОРИЯ ОТКРЫТИЙ
СТРУКТУРА ПЕРОКСИДА ВОДОРОДА
Схема показывает, что в структуре две плоскости, и каждая плоскость имеет одну пару ОН, угол между обеими плоскостями составляет 90,2 °, длина связи OO составляет 145,8 пм, а длина связи ОН составляет 98,8 пм (что равно 9,88 × 10-13 м). Две пары несвязанных электронов будут присутствовать в обоих атомах кислорода. Это доказывает теорию отталкивания электронов валентных оболочек.Атомы водорода всегда будут отталкивать несвязанные электроны кислорода. Таким образом, образуется изогнутая молекулярная форма.
Для получения перекиси водорода используются различные методы:
СВОЙСТВА ПЕРОКСИДА ВОДОРОДА
Свойства пероксида водорода следующие:
Химические свойства перекиси водорода следующие:
Перекись водорода действует как окислитель, так и как восстановитель в кислой и основной среде. Следующие реакции изображают картину:
ХРАНЕНИЕ ПЕРОКСИДА ВОДОРОДА
При воздействии солнечного света перекись водорода разлагается.Этот процесс разложения катализируется следами щелочных металлов. Поэтому перекись водорода можно хранить в покрытых воском стеклянных или пластиковых емкостях в темноте. Его также необходимо хранить вдали от частиц пыли, поскольку пыль может вызвать взрывное разложение этого соединения.ИСПОЛЬЗОВАНИЕ ПЕРОКСИДА ВОДОРОДА
Перекись водорода имеет ряд применений. Некоторые из них перечислены ниже:Следовательно, перекись водорода является одним из наиболее важных соединений.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Перекись водорода — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Авторы и авторства
Перекись водорода (H 2 O 2 ) представляет собой вязкую жидкость (т. Пл.: -0,89 ° C, точка кипения: 152,1 ° C, плотность: 1,448 г / см 3 при 20 ° C), обладающий сильными окислительными свойствами.
Обычно используется (в концентрациях обычно около 5%) для обесцвечивания человеческих волос, отсюда и фразы «пероксидный блондин» и «бутылочный блондин». При попадании в достаточной концентрации вызывает ожоги кожи. В более низких концентрациях (3%) он используется в медицине для очистки ран и удаления омертвевших тканей. Однако недавние исследования показали, что перекись водорода токсична для новых клеток и поэтому не рекомендуется для ухода за ранами.То же самое решение часто используется медицинскими работниками для удаления крови с ткани и оборудования.
H 2 O 2 получают путем сочетания электролиза серной кислоты и последующего гидролиза образующейся пероксодисерной кислоты:
2 H 2 SO 4 H 2 S 2 O 8 + H 2
H 2 S 2 O 8 + 2 H 2 OH 2 O 2 2 H 2 SO 4
2 H 2 OH 2 O 2 + H 2
Перекись водорода экзотермически разлагается на воду и газообразный кислород (46.87 ккал / моль). Однако при комнатной температуре скорость разложения очень мала, поэтому чистый H 2 O 2 является стабильным (метастабильным). Катализаторы (например, измельченное серебро, золото, платина, двуокись марганца, соли железа и меди, соли щелочных металлов, пыль, активированный уголь и т. Д.) Резко увеличивают скорость разложения. Высокие концентрации H 2 O 2 могут привести к взрыву при контакте с катализаторами. H 2 O 2 может быть стабилизирован добавлением фосфорной кислоты, дифосфата натрия, мочевой кислоты или барбитуровой кислоты.Чистый H 2 O 2 без каких-либо стабилизаторов может храниться только в стеклянных флаконах, покрытых парафиновым покрытием, или в флаконах из чистого алюминия (лучше 99.9%).
Авторы и авторство
Перекись водорода как дезинфицирующее средство
Перекись водородаБольшинство людей знает перекись водорода как соединение, обесцвечивающее волосы. Также его можно использовать для обеззараживания воды.
Когда была обнаружена перекись водорода?
Луи Жак Тенар открыл перекись водорода в 1818 году.Перекись водорода состоит из атомов кислорода и водорода. Их можно найти повсюду на Земле. Перекись водорода содержит комбинацию двух атомов водорода и двух атомов кислорода.
В окружающей среде можно найти перекись водорода в очень низких концентрациях. Газообразный перекись водорода образуется в результате фотохимических реакций в атмосфере, окружающей Землю. Его также можно найти в воде в небольших количествах.
Каковы характеристики перекиси водорода?
Перекись — это химическое соединение, которое содержит ион перекиси (O 2 2- ).
Ион пероксида состоит из одинарной связи между двумя атомами кислорода: (O-O) 2-. Это сильный окислитель.
Перекись водорода имеет химическую формулу H 2 O 2 и следующую структурную формулу:
H-O-O-H
Молекула перекиси водорода содержит один дополнительный атом кислорода по сравнению с более стабильной молекулой воды. Связь между двумя атомами кислорода, так называемая пероксидная связь, разрывается, в то время как образуются два радикала H-O.Эти радикалы быстро вступают в реакцию с другими веществами, при этом образуются новые радикалы и протекает цепная реакция. Растворы перекиси водорода выглядят как вода и могут неограниченно растворяться в воде. При высоких концентрациях эти растворы источают раздражающий кислый запах. Перекись водорода легко воспламеняется. При низких температурах затвердевает. Количество перекиси водорода в растворе выражается в массовых процентах. Для очистки воды используются концентрации перекиси водорода 35 или 50%.
Селективность
Перекись водорода используется для различных применений, поскольку она очень избирательна. Изменяя условия реакции (температура, pH, доза, время реакции и добавление катализатора), перекись водорода разрушает различные загрязнения.
Коррозионная активность перекиси водорода
Коррозионная активность технологической воды из-за перекиси водорода зависит от количества образующегося растворенного кислорода. Кислород разъедает железосодержащие металлы.Количество железа и pH больше влияют на коррозионную активность, чем концентрация перекиси водорода.
Разрушение перекиси водорода
Перекись водорода может распадаться во время транспортировки. Выделяются кислород и тепло. Сама перекись водорода легко воспламеняется, но кислород может усилить воспламенение других веществ. В разбавленных растворах тепло поглощается водой. В концентрированных растворах температура раствора повышена, что ускоряет разрушение перекиси водорода.Скорость разрушения умножается на 2,2 на каждые 10 ° C повышения температуры. Щелочность и наличие загрязнений также ускоряют разрушение перекиси водорода.
Для производства перекиси водорода используются специальные катализаторы, чтобы гарантировать, что перекись водорода не разрушается загрязнителями в воде.
Как производится перекись водорода?
С 1880 года перекись водорода является товарным продуктом. Впервые он был произведен в Соединенном Королевстве путем сжигания бариевой соли (Ba), в результате чего образовался пероксид бария (BaO 2 ).Впоследствии пероксид бария растворяли в воде и получали пероксид водорода. С 19 века производство перекиси водорода значительно увеличилось. Сегодня ежегодно производится около полумиллиарда килограммов.
Как транспортируется и хранится перекись водорода?
Пероксид водорода необходимо транспортировать в контейнерах из полиэтилена, нержавеющей стали или алюминия. При контакте перекиси водорода с легковоспламеняющимися веществами, такими как дерево, бумага, масло или хлопок (целлюлоза), может произойти самовозгорание.Когда перекись водорода смешивается с органическими веществами, такими как спирты, ацетон и другие кетоны, альдегиды и глицерин, могут произойти сильные взрывы.
Контакт перекиси водорода с такими веществами, как железо, медь, хром, свинец, серебро, марганец, натрий, калий, магний, никель, золото, платина, металлоиды, оксиды металлов или соли металлов, может привести к сильным взрывам. . Вот почему перекись водорода обычно транспортируют в разбавленном виде.
Каковы применения перекиси водорода?
Самым старым из известных способов применения перекиси водорода было отбеливание соломенных шляп, что было модно в начале двадцатого века.С 1920 по 1950 год перекись водорода производилась электролизом. Этот метод дает чистую перекись водорода. В настоящее время для получения перекиси водорода используются процессы самоокисления. Во время этих процессов водород является сырьем.
Универсальность перекиси водорода
Перекись водорода универсальна, ее можно использовать во многих областях. Его можно использовать во всех средствах массовой информации; воздух, вода, сточные воды и почвы. Иногда его используют в сочетании с другими агентами для усиления и ускорения процессов.Перекись водорода чаще всего используется для удаления загрязняющих веществ из сточных вод и воздуха. Он препятствует росту бактерий (например, биологическому обрастанию в водных системах) и может усиливать рост бактерий (например, биологическое восстановление загрязненных почв и грунтовых вод) за счет добавления кислорода. Его также можно использовать для обработки загрязнений, которые легко окисляются (например, железо и сульфиды), и загрязнений, которые трудно окислить (например, растворенных твердых веществ, бензина и пестицидов).
Наконец, его можно использовать для отбеливания бумаги, текстиля, зубов и волос или для производства продуктов питания, минералов, нефтехимических веществ или стирального порошка.В чистом виде перекись водорода используется в качестве источника кислорода для управления российскими подводными лодками.
Можно ли использовать перекись водорода в качестве окислителя?
Перекись водорода — сильный окислитель. Он более мощный, чем хлор (Cl 2 ), диоксид хлора (ClO 2 ) и перманганат калия (KMnO 4 ). Путем катализа перекись водорода может быть преобразована в гидроксирадикалы (ОН). Потенциал окисления перекиси водорода чуть ниже, чем у озона.
Таблица 1: Потенциалы окисления различных окислителей
Как дозируется перекись водорода?
Большинство применений перекиси водорода состоят из впрыскивания перекиси водорода в проточную воду. Никаких других химикатов или оборудования не требуется. Это приложение используется для контроля биологического роста, добавления кислорода, удаления остатков хлора и окисления сульфидов, сульфитов, металлов и других легко окисляемых материалов. Пригодность перекиси водорода для этих целей зависит от pH, температуры и времени реакции.
Каталитическая перекись водорода
Загрязнения, которые трудно окисляются, требуют активации перекисью водорода катализаторами (железом, марганцем или другими металлоидами). Эти катализаторы также можно использовать для усиления реакций перекиси водорода, которые в противном случае заняли бы часы или дни.
Что такое усовершенствованные процессы окисления?
Усовершенствованные процессы окисления — это новая разработка в области дезинфекции перекисью водорода.Эти процессы производят активные кислородные радикалы без вмешательства металлических катализаторов. Примеры — комбинация перекиси водорода с озоном (пероксоном) или ультрафиолетовым светом. Результатом этих методов является далеко идущее окисление трудноразлагаемых веществ без образования остатков или шлама. Эти методы используются во всем мире для очистки подземных вод, для очистки питьевой и технологической воды, а также для обеззараживания органических веществ и удаления из промышленных сточных вод.
Как работает дезинфекция перекисью водорода?
Перекись водорода используется в качестве дезинфицирующего средства. Он используется для лечения воспаления десен и для дезинфекции (питьевой) воды. Он также используется для борьбы с чрезмерным ростом микробов в системах водоснабжения и градирнях.
В США перекись водорода все чаще используется для очистки индивидуальных источников воды. Он используется для предотвращения образования цвета, вкуса, коррозии и образования накипи в результате разложения загрязнений (железо, марганец, сульфаты) и разложения микроорганизмами.Перекись водорода реагирует очень быстро. Затем он распадется на водород и воду без образования побочных продуктов. Это увеличивает количество кислорода в воде.
Механизм дезинфекции перекиси водорода основан на высвобождении свободных кислородных радикалов:
H 2 O 2 → H 2 O + O 2
Загрязнения разлагаются свободными радикалами кислорода, и осталась только вода. Свободные радикалы обладают как окислительными, так и дезинфицирующими свойствами.Перекись водорода удаляет белки путем окисления.
Пероксиды, такие как перекись водорода (H 2 O 2 ), перборат, пероксифосфат и персульфат, являются хорошими дезинфицирующими и окислителями. Как правило, они могут адекватно удалять микроорганизмы. Однако эти пероксиды очень нестабильны.
Пербораты очень токсичны. Перуксусная кислота (ПАК) — сильная кислота. В чистом виде он может быть очень агрессивным. Стабилизированные персульфаты могут использоваться для замены хлора при очистке сточных вод.
Используется ли перекись водорода для дезинфекции питьевой воды?
В 1950-х годах перекись водорода впервые была использована для дезинфекции питьевой воды в Восточной Европе. Он известен своей высокой окислительной и биоцидной эффективностью. Перекись водорода нечасто используется для дезинфекции питьевой воды, но ее популярность, похоже, растет. Его часто используют в сочетании с озоном, серебром или УФ.
Используется ли перекись водорода для дезинфекции бассейна?
Применение перекисей для дезинфекции и очистки воды ограничено.В последнее время были разработаны более стабильные формы, которые можно использовать для применения в плавательных бассейнах.
Для дезинфекции перекисью водорода требуется большая доза. Основным недостатком является малая дезинфицирующая и окислительная способность перекиси водорода в активных концентрациях (десятки миллиграммов на литр), необходимых для дезинфекции бассейна. Еще одна проблема — быстрое разложение перекиси водорода в воде и наличие кислородных радикалов. За счет добавления стабилизатора замедляется разложение перекиси водорода и сохраняется дезинфицирующая способность.
По сравнению с хлором, бромом, озоном и другими дезинфицирующими средствами перекись водорода не является очень сильным дезинфицирующим средством. Дезинфекция плавательных бассейнов перекисью водорода не допускается, если она не используется в сочетании с другими дезинфицирующими средствами (УФ, озон, соли серебра или квартовые соли аммиака). Перекись водорода улучшает дезинфицирующую способность других дезинфицирующих средств.
Можно ли использовать перекись водорода для дезинфекции воды градирни?
Перекись водорода может использоваться для дезинфекции воды градирни в сочетании с другими дезинфицирующими средствами.Перуксусная кислота (CH 3 COOH, PAA) также может использоваться для дезинфекции воды градирни.
Удаляет ли перекись водорода хлор?
Перекись водорода можно использовать для дехлорирования, другими словами, для удаления остаточного хлора. Остаточный хлор образует коррозионные кислоты при окислении воздухом или конденсатом в технологических системах.
Когда хлор реагирует с перекисью водорода, перекись водорода распадается на воду и кислород. Газообразный хлор гидролизуется до хлорноватистой кислоты (HOCl), которая впоследствии ионизируется до ионов гипохлорита (OCl).
Cl 2 + HOCl + H + + Cl
HOCl + H + + Cl
После этого пероксид водорода вступает в реакцию с гипохлоритом:
OCl — + H 2 O 2 (г) -> Cl — + H 2 O + O 2
Реакция между пероксидом водорода и гипохлоритом протекает очень быстро. Другие органические и неорганические вещества не могут реагировать с гипохлоритом.
Какие преимущества и недостатки использования перекиси водорода?
Преимущества
В отличие от других химических веществ, перекись водорода не образует остатков или газов.Безопасность зависит от применяемой концентрации, поскольку перекись водорода полностью растворяется в воде.
Недостатки
Перекись водорода — мощный окислитель. Реагирует с множеством веществ. Поэтому его разбавляют во время транспортировки в качестве меры безопасности. Однако для дезинфекции перекисью водорода требуются высокие концентрации.
Перекись водорода медленно разлагается на воду и кислород. Повышение температуры и наличие загрязнений усиливают этот процесс.
Концентрация перекиси водорода в растворе медленно снижается. Это вызвано следующей реакцией:
2 H 2 O 2 → 2 H 2 O + O 2
Это окислительно-восстановительная реакция. Молекулы водорода частично действуют как восстановители, а частично как окислители.
Эффективна ли перекись водорода?
Эффективность перекиси водорода зависит от нескольких факторов, таких как pH, катализаторы, температура, концентрация перекиси и время реакции.
Какое влияние на здоровье оказывает перекись водорода?
Воздействие перекиси водорода происходит при вдыхании влаги или тумана, при поглощении пищи и через контакт с кожей или глазами. Перекись водорода может раздражать глаза, кожу и слизистые оболочки. Воздействие на глаза концентраций 5% и более может привести к необратимому повреждению глаз. Испытания на лабораторных животных, проведенные Американским международным агентством по изучению рака (IARC), показывают, что перекись водорода может быть канцерогенной для животных.Лабораторные тесты с бактериями показывают, что перекись водорода обладает мутагенным действием; он изменяет и повреждает ДНК. Когда люди вдыхают перекись водорода, это вызывает раздражение легких. Воздействие на кожу вызывает болезненные волдыри, ожоги и побеление кожи. Органы, наиболее чувствительные к воздействию перекиси водорода, — это легкие, кишечник, тимус, печень и почки. Последствия хронического воздействия на человека неизвестны. Влияние на размножение и развитие пока не продемонстрировано.
Каковы законы по перекиси водорода?
EU
Перекись водорода не упоминается в Европейском стандарте питьевой воды 98/83 / EC.
США
В США перекись водорода зарегистрирована как пестицид Агентством по охране окружающей среды в 1977 году.
Какие вещества можно сочетать с перекисью водорода?
Для дезинфекции перекись водорода можно комбинировать с другими средствами. Например перуксусная кислота и пероксон.
Перекись водорода — обзор
5.1 Введение
Перекись водорода — универсальный и широко используемый окислительный отбеливатель в целлюлозно-бумажной промышленности (Anderson, 1992; Anderson and Amini, 1996; Gullichsen, 2000; Troughton and Sarot , 1992; Нельсон и др., 1995, 1998; Lachenal et al., 1992, 1996; Рив, 1996; Пикка и др., 2000; Биман и Райхерт, 1953; Холладей и Солари, 1963; Эндрюс и Сингх, 1979). Он разлагается, давая только воду и кислород, поэтому идеально подходит для применений, в которых воздействие на окружающую среду сточных вод должно быть минимальным. В области химического отбеливания целлюлозы перекись водорода используется в основном в качестве усиления существующих стадий отбеливания (Anderson, 1992; Anderson and Amini, 1996). Многие предприятия используют перекись водорода в качестве усиления на стадии экстракции после хлорирования, с дополнительным усилением кислородом или без него, а также на второй стадии экстракции.Перекись водорода в щелочной экстракции позволяет сократить использование хлорированных соединений, а также дает ряд улучшений качества целлюлозной массы и сточных вод заводов отбеливания (Walsh et al., 1991). Мельницы также используют пероксид для уменьшения общего количества применяемого диоксида хлора на последней стадии D. На заключительном этапе или в отбеленном контейнере для хранения высокой плотности пероксид является хорошим отбеливающим агентом и может обеспечить повышенную стабильность белизны. Когда пероксид используется для усиления стадии экстракции, условия процесса относительно мягкие, и разложение не является основным фактором.Однако, когда пероксид используется в качестве первичного отбеливающего и делигнификационного реагента, обычно необходимо работать на стадии пероксида при более высоких температурах (> 100 ° C) и под давлением (Lachenal et al., 1992; Carlos et al., 1980). . В этих условиях необходимо управлять двумя конкурирующими реакциями (отбеливание целлюлозы и разложение пероксида). Поскольку переходные металлы катализируют разложение перекиси водорода, эту нежелательную реакцию необходимо минимизировать путем снижения содержания металлов в пульпе.Специально разработанные ступени подачи перекиси водорода (PO) под давлением были установлены на промышленных предприятиях и привели к улучшению реакции отбеливания при более низком потреблении перекиси водорода (Tibbling and Dillner, 1993; Dillner and Tibbling, 1994; Germgard and Norden, 1994). Коммерческие последовательности, объединяющие стадию озона и стадию (PO), приняли форму OZQ (PO).
Условия этих усиленных стадий экстракции обычно соответствуют условиям исходных стадий экстракции на мельнице.К счастью, перекись водорода хорошо работает в обычных условиях экстракции в обычной последовательности, и использование хлора и отбеливающих химикатов на основе хлора можно сократить с помощью умелого применения умеренных количеств перекиси водорода. Необходимость сокращения использования газообразного хлора для отбеливания целлюлозы больше не является предметом обсуждения. Давление рынка все в большей степени подталкивает целлюлозные заводы к сокращению выбросов всех сточных вод с конечной целью полностью закрыть завод.Если рециркулирующие потоки содержат хлорид-ионы, то закрыть комбинат будет сложно из-за их высокой коррозионной активности. Как следствие, одним из этапов на пути к закрытию завода является разработка жизнеспособной, полностью свободной от хлора (TCF) последовательности. В краткосрочной перспективе последовательность TCF позволит предприятиям работать с наименьшим загрязнением окружающей среды, в то время как будут разработаны необходимые процессы рециркуляции. Кроме того, процесс отбеливания TCF не вызывает образования хлорорганических веществ в целлюлозе.
Перекись водорода является сильным кандидатом для использования в последовательностях TCF (van Lierop et al., 1993; Troughton et al., 1994; Lapierre et al., 1995b). Перекись водорода наиболее известна своими реакциями отбеливания при щелочном pH при механическом и химическом отбеливании целлюлозы, а также при удалении краски. Перекись водорода также может использоваться в качестве исходного химического вещества для производства пероксикислот. Пероксикислоты, которые имеют более высокий окислительный потенциал, чем пероксид водорода, способны селективно окислять лигнин (Basta et al., 1994a; Амини и Вебстер, 1994; Либерготт, 1994; Андерсон и др., 1995; Seccombe et al., 1994; Geng et al., 1993; Девенинс и др., 1993, 1994a, b; Поппиус-Левлин и др., 1991; Лай и Сарканен, 1968). Пероксикислоты могут увеличить порог белизны целлюлозы TCF на 3–4 пункта при применении в начале последовательности отбеливания крафт-TCF (Basta et al., 1994a). Они также исследуются как средства активации кислородных стадий и стадий отбеливания перекисью водорода (Amini and Webster, 1994; Liebergott, 1994).
При последовательностях, не содержащих хлора, условия, в которых используется перекись водорода, должны быть адаптированы к тем, в которых она действует наиболее эффективно. Эти условия часто можно легко найти на существующих целлюлозно-бумажных комбинатах. Недавние успехи в отбеливании перекисью водорода стали возможными благодаря лучшему пониманию роли ионов металлов в разложении перекиси (Lapierre et al., 1995b). Перекись водорода не является хорошим делигнифицирующим агентом, и в обычных условиях для крафт-целлюлозы остаточное количество остается в щелоке.Если используются более жесткие условия, перекись разлагается ионами металлов в пульпе. Если используется правильная процедура обращения с металлом, температура и время отбеливания могут быть увеличены, чтобы получить более выгодное потребление перекиси водорода и более высокую конечную белизну.
Перекись водорода — обзор
5.1.3 Перекись водорода: H
2 16 O 2Перекись водорода имеет неплоскую структуру, как показано на рис. 5.2. Единственным элементом симметрии в этой геометрии является бинарная ось, нормальная к связи O – O, и можно использовать точечную группу C 2 , если можно пренебречь эффектами туннелирования через торсионный барьер вокруг связи O – O. .Отметим, что эта молекула может принимать две стереоизомерные геометрии, которые не могут быть совмещены, связанные друг с другом инверсией E *, и существовала бы в двух формах с противоположной оптической активностью, как и для всех геометрий, лишенных неправильных операций симметрии, если взаимное преобразование двух форм было невозможно. Статистические веса предполагаемой «жесткой» перекиси водорода могут быть определены стандартными методами. В таблице 5.6 показаны символы для группы C 2 , а также символы, необходимые для полных волновых функций и приводимого представления ядерного спина (спин 16 O равен 0).В этом случае нет различия симметрии для положительных и отрицательных состояний, потому что волновые функции с противоположной четностью ведут себя противоположным образом только при неправильных действиях. Таким образом, четность бесполезна при классификации уровней молекул с оптической активностью, а вырождение, связанное с двумя разными четностями, отражается существованием двух разных стереоизомеров, которые не могут быть взаимно преобразованы.
Рисунок 5.2. Две зеркальные формы молекулы перекиси водорода, которые могут быть взаимно преобразованы путем инверсии через центр масс.
Таблица 5.6. Таблица символов группы C 2 .
| C 2 | E | C 2 | ||
|---|---|---|---|---|
| (12), (34) | ||||
| A 907 | B | 1 | -1 | |
| Γtot ± | 1 | -1 | = B | |
| χ n.spin | 4 907 |
Мы также сообщаем о характере разрешенных полных ровибронно-ядерных спиновых состояний и приводимого представления ядерного спина на основе произведений спиновых функций отдельных ядер для «жесткой» перекиси водорода.
Из таблицы 5.6 мы находим, что ровибронные уровни симметрии A совместимы с функциями ядерного спина B со статистическим весом 1, а уровни симметрии B совместимы с функциями ядерного спина A со статистическим весом 3.
Но на самом деле взаимопревращение происходит в перекиси водорода, в основном проходя через конформацию транс , где барьер значительно ниже, чем через конформацию цис , несмотря на необходимое большее торсионное смещение.Фактически, эта молекула не обладает оптической активностью. В результате взаимного превращения два отдельных стереоизомера предполагаемой жесткой молекулы, которые будут вести себя как две отдельные молекулы, образуют единую «гибкую» молекулу. Таким образом, количество уровней «гибкой» молекулы удваивается по отношению к каждому из двух гипотетических «жестких» изомеров, и это объясняется наличием уровней с положительной и отрицательной четностями. Инверсия, которая управляет взаимным преобразованием, является элементом симметрии «гибкой» молекулы.Таким образом, группа, подходящая для перекиси водорода, фактически представляет собой G 4 = C 2 × ( E , E *). В эту группу входят неправильные операции, и тогда можно выделить положительные и отрицательные состояния.
Определение статистических весов для уровней перекиси водорода может быть выполнено с помощью таблицы 5.7. Суммарные разновидности ровибронно-ядерного спина должны быть B + для положительных уровней и B — для отрицательных уровней, поэтому разрешенные продукты ровибронного и ядерного спина могут быть только типа A × B.Оказывается, что положительные уровни ровиброника могут быть только A + со статистическим весом 1 и B + со статистическим весом 3, тогда как отрицательные уровни rovibronic могут быть только A — со статистическим весом 1 и B — со статистическим весом. вес 3. В этом случае обозначение разрешенных видов ровибронной симметрии явно содержит метку четности.
Таблица 5.7. Таблица символов группы G 4 .
| G 4 | E | C 2 | E * | E * C 2 | ||||
|---|---|---|---|---|---|---|---|---|
| (12), (34) | (34) * | |||||||
| A + | 1 | 1 | 1 | 1 | ||||
| B + | 1 | −1 9092|||||||
| A — | 1 | 1 | −1 | −1 | ||||
| B — | 1 | −1 | ||||||
| −1 Γtot + | 1 | −1 | 1 | −1 | = B + | |||
| Γtot− | 1 | −1 | −1 | = 1 | ||||
| χ п. | ||||||||